Нарушение обмена аминокислот
Аминокислоты поступают в кровь и ткани из пищеварительного тракта; кроме того, они образуются при деструкции тканевых белков под действием внутриклеточных катепсинов (протеиназ).
Основная часть аминокислот используется в организме в качестве строительных блоков при синтезе белков. Кроме того, аминокислоты используются для синтеза пуриновых и пиримидиновых оснований, гормонов, гема, различных биологически активных пептидов (интерлейкины, факторы роста и т.д.), меланина, глюкозы, жирных кислот и ряда других веществ. Глицин и глутамат играют роль нейромедиаторов в ЦНС. Аминокислоты, не использованные для вышеупомянутых целей, подвергаются окислению до СО2 и Н2О с освобождением энергии.
В норме при окислении аминокислот освобождается 10-15% образующейся в организме энергии. Окисление аминокислот усиливается при избыточном поступлении их в организм, при голодании, сахарном диабете, гипертиреозе, снижении синтеза белков и некоторых других состояниях.
Катаболизм большинства аминокислот начинается с отщепления от них аминогруппы, что происходит в 2-х типах реакций: трансаминирования и дезаминирования.
Трансаминирование- перенос аминогруппы аминокислоты на α-кетокислоту, в результате образуются новая кетокислота и новая аминокислота.
Процесс трансаминирования легко обратим и катализируется трансаминазами,коферментом которых является пиридоксальфосфат - производное витамина В6(служит переносчиком аминогрупп). Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях выше остальных, - глутамат, аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват, оксалацетат. Основным акцептором аминогрупп служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат - донор аминогрупп, способный передавать их любым α-кетокислотам для образования новых аминокислот (рис. 12-40). Кетокислоты, образующиеся при трансаминировании (например, пировиноградная), также могут использоваться для синтеза глюкозы или окислиться до СО2 и Н2О подобно глюкозе и жирным кислотам. Трансаминирование - начальный этап катаболизма аминокислот, в результате которого аминный азот перераспределяется в тканях организма. Реакции трансаминирования играют роль в превращении аминокислот в кетокислоты или в образовании из кетокислот ряда заменимых аминокислот в том случае, если организм испытывает в них потребность. При трансаминировании общее количество аминокислот в клетке не меняется.
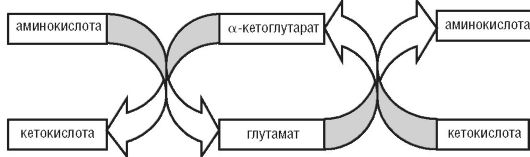 Рис. 12-40.Трансаминирование
Рис. 12-40.Трансаминирование
Нарушение процесса трансаминированияв целом организме происходит при гиповитаминозе В6, при недостатке α-кетокислот (голодание, сахарный диабет). Нарушение трансаминирования в отдельных органах, например в печени, происходит при некрозе клеток, что сопровождается выходом трансаминаз в кровь. Такое же явление имеет место при инфаркте миокарда. В поврежденных клетках может быть нарушен синтез белковой части трансаминаз.
Дезаминирование- реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота, которая может использоваться в реакциях трансаминирования, и выделяется молекула аммиака. Процесс окислительного дезаминирования снижаетсяв связи с ослаблением трансаминирования, при гипоксии, гиповитаминозах В2, РР, С, белковом голодании.
Нарушение процессов трансаминирования и окислительного дезаминирования аминокислот ограничивает их использование для синтеза глюкозы, жирных кислот, заменимых аминокислот, а также их окисление с освобождением энергии. При этом повышается содержание свободных аминокислот в сыворотке крови и в моче (гипераминоацидемияи гипераминоацидурия),снижается синтез мочевины. Такие нарушения особенно выражены при обширных повреждениях гепатоцитов (вирусные и токсические гепатиты и др.), так как в этих клетках метаболизм аминокислот происходит наиболее интенсивно.
Наряду с внепочечной гипераминоацидурией, обусловленной усиленным поступлением аминокислот из крови в мочу, существует почечная форма гипераминоацидурии, связанная с нарушением реабсорбции аминокислот в почечных канальцах, при этом содержание аминокислот в сыворотке крови нормально или даже пони-
жено (см. главу 19). Гипераминоацидурия (физиологическая) обнаруживается у детей раннего возраста в связи с функциональной неполноценностью (незрелостью) эпителия почечных канальцев; у беременных повышается экскреция с мочой гистидина и ряда других аминокислот.
Одним из путей метаболизма аминокислот является их декарбоксилирование,которое состоит в отщеплении от аминокислоты α-карбоксильной группы. В результате образуются СО2 и биогенные амины: гистамин - из гистидина, серотонин - из 5-окситриптофана, тирамин - из тирозина, γ-аминомасляная кислота (ГАМК) - из глутаминовой, дофамин - из диоксифенилаланина и некоторые другие.
Эти процессы необратимы и катализируются декарбоксилазами,коферментом которых является пиридоксальфосфат (витамин В6);при его дефиците образование биогенных аминов снижается. В частности, уменьшается образование ГАМК, которая является основным тормозным нейромедиатором, как следствие этого наблюдается частое развитие судорог. Биогенные амины обладают высокой физиологической активностью. Наряду с ГАМК, серотонин и дофамин являются также нейромедиаторами в ЦНС, их повышенное или пониженное содержание в ткани мозга играет роль в патогенезе некоторых форм нейропатологии (нервной депрессии, паркинсонизма, шизофрении). Повышенное образование в организме серотонина (при опухоли, развивающейся из энтерохромафинных клеток кишечника) сопровождается спазмом мускулатуры бронхов и кишечника, диареей, усилением агрегации тромбоцитов; кроме того, серотонин является мощным вазоконстриктором. Хорошо известна роль гистамина в появлении болевых ощущений, развитии воспаления и аллергических реакций.
Устранение избытка биогенных аминовпроисходит при участии аминооксидаз,которые катализируют превращение их в альдегидыпосле отщепления аминогруппы в виде NH3. Серотонин превращается в оксииндолилуксусную кислоту, которая выделяется с мочой.
Наследственные нарушения обменанекоторых аминокислот(см. раздел 5.1).
Дата добавления: 2016-07-11; просмотров: 2219;











