Задание к подразделу 4.4
Рассмотрите коррозию гальванопары, используя потенциалы (табл. П.7), укажите анод и катод соответствующей гальванопары в различной коррозионной среде, рассчитайте ЭДС, напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе.
| Номер задания | Коррозионная среда | ||
| а) H2O + O2 | б) NaOH + H2O | в) H2O + Н+ | |
| 321. | Fe / Zn | Zn / Al | Pb / Zn |
| 322. | Fe / Ni | Fe / Zn | Al / Cu |
| 323. | Pb / Fe | Cd / Cr | Al / Ni |
| 324. | Cu / Zn | Al / Cu | Sn / Cu |
| 325. | Zn / Fe | Fe / Cr | Co / Al |
| 326. | Zn / Al | Pb / Zn | Cr / Ni |
| 327. | Cr / Cu | Pb / Cr | Bi / Ni |
| 328. | Cu / Al | Cr / Zn | Fe / Mg |
| 329. | Zn / Sn | Mg / Cd | Cr / Bi |
| 330. | Co / Mg | Zn / Fe | Pb / Al |
| 331. | Pb / Zn | Bi / Ni | Cd / Al |
| 332. | Bi / Ni | Cu / Zn | Fe / Ni |
| 333. | Fe / Mg | Fe / Cu | Co / Cd |
| 334. | Sn / Fe | Pb / Zn | Cr / Fe |
| 335. | Cr / Fe | Fe / Mg | Co / Cu |
| 336. | Fe / Cr | Cr / Cu | Cr / Cu |
| 337. | Fe / Cu | Cd/ Zn | Cd/ Zn |
| 338. | Zn / Cu | Cr / Ni | Cr / Cd |
| 339. | Mg / Cu | Cr / Cd | Zn / Al |
| 340. | Sn / Cu | Bi / Ni | Bi / Ni |
Электролиз растворов
Электролиз – это совокупность окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электрохимическую систему, состоящую из двух электродов и электролита.
Электрод, на котором происходит восстановление, называется катодом, он заряжен отрицательно. Электрод, на котором происходит окисление, называется анодом, он заряжен положительно.
При электролизе водных растворов могут протекать процессы, связанные с электролизом воды, т.е. растворителя.
Катодные процессы
На катоде возможно восстановление:
· катионов металла Ме n+ + nē = Me;
· катиона водорода (свободного или в составе молекул воды):
2H + + 2ē = H 2 ( в кислой среде) ;
2H2O + 2 ē =H 2+ 2 OH — ( в нейтральной и щелочной средах).
Для выбора приоритетного процесса следует сравнить стандартные электродные потенциалы металла и водорода (табл. П.6, П.7). Потенциал восстановления катионов водорода необходимо использовать с учетом перенапряжения,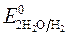 » -1 В.Все металлы по своему поведению при электролизе водных растворов можно разделить на 3 группы.
» -1 В.Все металлы по своему поведению при электролизе водных растворов можно разделить на 3 группы.
1. Активные металлы (Li - Al) из-за низкой окислительной способности их ионов на катоде не осаждаются, вместо них идет восстановление ионов водорода.
2. Металлы средней активности (Mn, Zn, Fe, Sn) могут осаждаться на катоде с одновременным выделением водорода.
3. Малоактивные металлы (стоящие в ряду напряжений после водорода) из-за высокой окислительной способности их ионов осаждаются на катоде без выделения водорода.
Анодные процессы
На аноде возможны процессы окисления:
· материала анода Ме - nē = Me n+
· молекул воды 2H2O - 4ē =О 2+ 4H +
· анионов солей
2Cl — - 2ē = Cl2 NO2— - 2ē + H2O = NO3— + 2H +
Анионы кислородосодержащих кислот, имеющие в своем составе атом
элемента в высшей степени окисления (SO4 2—, NO3— и др.), при электролизе водных растворов на аноде не разряжаются.
С учетом перенапряжения величину потенциала выделения кислорода нужно считать равной 1,8 В.
Пример 1. Электролиз водного раствора сульфата калия с инертными электродами:
K2SO4 = 2K + + SO42—
 (-) Kатод K+ H2O(+) Aнод SO4 2— H2O
(-) Kатод K+ H2O(+) Aнод SO4 2— H2O
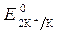 = - 2,92 B ;
= - 2,92 B ; 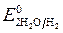 = -1 B. Сульфат-ионы не разряжаются.
= -1 B. Сульфат-ионы не разряжаются.
Так как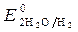 >
> 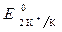 ,
, 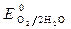 » 1,8 B.
» 1,8 B.
происходит восстановление воды: 2H2O - 4ē = O2 + 4 H +
2H2O +2ē = H 2+ 2 OH —
среда щелочная среда кислая
Пример 2. Электролиз водного раствора хлорида олова с инертными электродами:
SnCl 2 = Sn 2+ + 2Cl —
 (-) Kатод Sn 2 +, H2O(+) Aнод Cl —, H2O
(-) Kатод Sn 2 +, H2O(+) Aнод Cl —, H2O
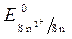 = - 0,136 B ;
= - 0,136 B ; 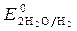 = -1B.
= -1B. 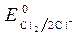 = 1,36 В ;
= 1,36 В ; 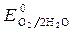 » 1,8 B.
» 1,8 B.
Так как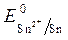 >
> 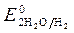 , Так как
, Так как 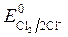 <
<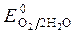 ,идет идет процесс восстановления процесс окисления ионов Сl -:
,идет идет процесс восстановления процесс окисления ионов Сl -:
ионов олова: Sn2+ + 2 ē = S n 2Cl — - 2 ē = Cl 2
Пример 3. Электролиз сульфата меди с медным анодом:
CuSO4 =Cu2+ + SO42-
 (-) Kатод Cu 2+ H2O (+) Aнод -Сu SO4 2— H2O
(-) Kатод Cu 2+ H2O (+) Aнод -Сu SO4 2— H2O
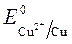 = + 0,34 B ;
= + 0,34 B ; 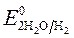 = -1 B.
= -1 B. 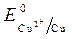 = + 0,34 B;
= + 0,34 B; 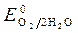 » 1,8 B.
» 1,8 B.
Так как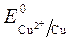 >
> 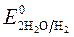 , Сульфат-ионы не разряжаются.
, Сульфат-ионы не разряжаются.
происходит восстановление Так как 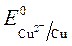 <
<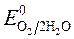 ,
,
ионов меди:Cu 2+ +2ē = Cu анод растворяется: Cu - 2ē = Cu 2+
Количественные соотношения при электролизе определяют в соответствии с законами, открытыми М. Фарадеем (1834).
Обобщенный закон Фарадея связывает количество вещества, образовавшегося при электролизе, со временем электролиза и силой тока:
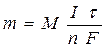 ,
,
где m - масса образовавшегося вещества , г;
М - молярная масса вещества, г/ моль;
n - количество электронов, участвующих в электродном процессе;
I - сила тока, А;
t - время электролиза, с;
F - константа Фарадея (96500 Кл/моль).
Для газообразных веществ, выделяющихся при электролизе, формулу использют в виде 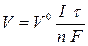 ,
,
где V- объем газа, выделяющегося на электроде; V 0 - объем 1 моль газообразного вещества при нормальных условиях (22,4 л/моль).
Пример 4. Рассчитать массу олова и объем хлора при нормальных условиях, выделившихся при электролизе раствора хлорида олова с инертными электродами в течение 1 часа при силе тока 4А.
Решение.


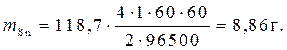
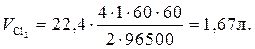
Дата добавления: 2016-07-11; просмотров: 2619;











