ВВЕДЕНИЕ В ЯДЕРНУЮ ФИЗИКУ
Строение вещества
Людвиг Больцман, австрийский физик (1844 – 1906), один из создателей современной кинетической теории вещества, заметил, что главная цель естественных наук – раскрыть единство сил природы.
Современная наука выявила это единство на достаточно глубоком уровне.
Современное представление о структуре мира формировалось и продолжает формироваться с созданием теории объединённых взаимодействий и параллельно с изменением представлений о фундаментальных частицах, составляющих вещество.
Дуализм «частица – вещество» - один из лейтмотивов физики, и в разные периоды на первый план выдвигалось либо одно, либо другое.
Так, Рене́ Декарт и Дж. К. Максвелл в основе построения Мира видели взаимодействие, а Исаак Ньютон и Хендрик Антон Лоренц – частицы, хотя последние и не проводили резкой грани между ними. И по мере открытия переносчиков взаимодействий эта грань между взаимодействиями и частицами постепенно исчезает.
Возможно, со временем понятия частиц и взаимодействий, как отдельных структурных образований реального мира, потеряют свой смысл и будут заменены другими новыми понятиями и структурно-функциональными единицами, порождающими в некотором приближении знакомые нам частицы и взаимодействия.
Исаак Ньютон представлял мир состоящим из частиц, между которыми действовали силы тяготения, а Пьер СимонЛаплас в своей «Системе мира» эту простоту и упорядоченность в таком представлении довёл до известного совершенства.
В представлении Дж. К. Максвелла мир намного сложнее. Было введено понятие хаоса (высшая форма организации материи, вещества, системы) и, главное, электромагнитного поля. Колоссальным явилось достижение Максвелла, объединившее в одной стройной системе электрическое и магнитное взаимодействия. Но это и привело его к большим затруднениям при попытке понять природу электрических зарядов. Его уравнения оказались совершенно симметричными, т.е. соразмерными, инвариантными (неизменными при тех или иных преобразованиях) относительно электрического и магнитного полей, но несимметричными относительно источников этих полей. Вот почему из-за отсутствия возможности проверить экспериментально, на опыте гипотезы о зарядах, т.е. источниках полей, Дж. Максвелл в этом направлении дальше не пошёл.
Хендрик Антон Лоренц создал классическую электронную теорию и разработал электродинамику движущихся сред и вплотную подошёл к созданию теории относительности, т.е. классической теории, рассматривающей пространственно-временные свойства физических процессов, созданной в 1905 году Альбертом Эйнштейном.
Применение теории относительности к атомам породило квантовую механику, а затем и квантовую электродинамику. В результате была создана квантовая теория поля.
После открытия в 1896 г. Анри Беккерелем радиоактивности и в 1897 г. Дж. Томпсоном электрона стало очевидно, что атом представляет систему заряженных частиц.
В 1911 г. Э. Резерфорд предложил планетарную модель атома, а первую квантовую теорию атома на её основе в 1913 г. создал Нильс Бор.
Позднее на основе квантовой механики была построена последовательная квантовая теория атома. В 30-40 годы в неё вошли разделы, касающиеся структуры и свойств ядра.
Согласно установившимся представлениям вещество состоит из атомов и молекул, состоящих из соединений атомов.
Только инертные газы существуют в виде атомов, все остальные вещества - в виде молекул.
Существует несколько теорий строения вещества и атомов. Наиболее признанная планетарная модель Э. Резерфорда (1911 г.), развитая Н. Бором (1913 г.). Согласно этой модели в центре атома находится ядро с положительным зарядом, а вокруг него электронные оболочки, на которых по эллиптическим орбитам перемещаются электроны, заряженные отрицательно.
Число электронных оболочек может достигать 7 и соответственно изнутри кнаружи обозначаются: K, L, M, N, O, P, Q.
Количество электронов соответствует количеству положительно заряженных протонов ядер атомов и распределяется по оболочкам согласно формуле N = 2n2 следующим образом: К - 1 электрон у водорода и 2 у остальных атомов, L – от 1 до 8 электронов, M – от 1 до 18 электронов, N – от 1 до 32 электронов, O – от 1 до 32 электронов, P – от 1 до 8-11 электронов, Q – 1 электрон у франция и по 2 электрона у всех остальных атомов.
Электрон несёт один элементарный отрицательный заряд электричества, встречающийся в природе и принят в ядерной физике за 1 единицу для измерения величины электрических зарядов.
Энергетический эквивалент электрона составляет 0,511 МэВ, а масса покоя (скорость равна нулю) равна безразмерной величине 0,000548 атомной единицы массы (а.е.м.).
За 1 а.е.м. условно принята 1/12 массы атома изотопа углерода 12С, равная 1,6605655·10-27 кг. Энергия 1 а.е.м. равна 931 Мэв.
За 1 эВ принята кинетическая энергия движения одного электрона, проходящего электрическое поле от катода к аноду при разности потенциалов в 1 вольт.
Каждый электрон имеет собственный момент вращения - спин, т.е. собственный момент количества движения микрочастицы, имеющий квантовую природу и не связанный с движением частицы как целого. Единица измерения спина: ђ - постоянная Планка (целые: 0, 1, 2, ... и полуцелые: 1/2, 3/2, 5/2, ...).
На электроны действуют центростремительные кулоновские силы и центробежные силы инерции, а также отталкивающие силы одноимённо заряженных электронов.
Энергетическая связь электронов с ядром в зависимости от электрического слоя не одинакова и наибольшая с K-слоем. С увеличением атомного номера элемента она возрастает.
Следовательно, электроны внешних орбит менее прочно удерживаются и на свой отрыв от атома требуют меньше энергии.
На внешних орбитах она не превышает 1-2 эВ, а в K-слое во много раз больше: углерод - 280 эВ, стронций-90 - 16 кэВ, цеззий-137 – 36 кэВ, уран-235 - 280 кэВ.
Согласно протонно-нейтронной теории строения ядра атома, впервые сформулированной в 1932 г. Д.Д. Иваненко и Е.Г. Гапоном, а затем развитой В. Гейзенбергом, ядра атомов состоят из протонов и нейтронов.
Протон (р) - элементарная частица, масса которой в 1840 раз больше массы электрона и равна 1,00758 а.е.м., имеет один элементарный положительный заряд.
Количество протонов в ядре определяет физические свойства элемента, соответствует порядковому номеру его в таблице Д.И. Менделеева и называется атомным номером или зарядовым числом (Z).
Нейтрон (n) – электрически нейтральная частица с массой, равной 1,00898 а.е.м., то есть больше массы протона на величину массы одного электрона.
Нейтрон не стабилен с периодом полураспада 12,8 минуты и распадается на протон, электрон и нейтрино:
n → p + ē +  .
.
Протон и нейтрон в ядре с частотой 1023 с-1 обмениваются π-мезонами и превращаются один в другой:
p → π+ + n; p ← π+ + n; p → π- + n; p ← π- + n;
Отсюда, протоны и нейтроны были названы нуклонами (от греческого нуклеус - ядро), как проявление двух состояний одной частицы.
Сумма протонов (Z) и нейтронов (N) в ядре называется массовым числом (А):
А = N + Z.
Следовательно, N = A – Z.
При обозначении атомов применяется символика:  , где
, где 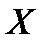 - символ элемента.
- символ элемента.
Примеры:
 , т.е. ядро углерода содержит 12 нуклонов и из них 6 протонов.
, т.е. ядро углерода содержит 12 нуклонов и из них 6 протонов.
 , т.е. ядро натрия содержит 23 нуклона и из них 11 протонов.
, т.е. ядро натрия содержит 23 нуклона и из них 11 протонов.
В зависимости от набора протонов, нейтронов и энерговооружённости атомы обладают разными физическими характеристиками.
Изотопы - атомы с одинаковым количеством протонов, но различные по числу нейтронов. Их спектры и химические свойства весьма близкие.
Большинство (71 из 90) природных элементов представляют собой смесь из 2-10 изотопов.
Изомеры - атомы с одинаковым массовым числом, ядра их находятся в различном энергетическом состоянии.
Изомеры с избытком энергии находятся в метастабильном состоянии и обозначаются буквой "m".
Например: 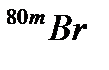 .
.
Они обладают разным периодом полураспада, энергией и видом излучения. Переход в стабильное состояние происходит за счёт γ-излучения или внутренней конверсии, т.е. передачи энергии ближайшим электронам K- или L-слоёв. В результате происходит вылет одного из них за пределы атома, сопровождающийся рентгеновским или оптическим излучением.
Изобары - атомные ядра разных химических элементов с одинаковым массовым числом:
 - аргон,
- аргон, 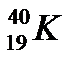 - калий,
- калий,  - кальций.
- кальций.
Изотоны - атомные ядра разных химических элементов с одинаковым числом нейтронов:
 - углерод,
- углерод,  - азот, т.е. они имеют по 7 нейтронов.
- азот, т.е. они имеют по 7 нейтронов.
Ядра атомов, состоящие только из протонов - очень прочные образования с большими силами сцепления между нуклонами. Большинство же ядер атомов состоит из протонов и нейтронов. Считают, что ядерные силы возникают в процессе непрерывного обмена между нуклонами и пионами (пи-мезонами) - квантами ядерного поля, действующими на очень коротких расстояниях.
Ядерные силы обладают свойством насыщения, т.е. каждый нуклон взаимодействует с только ограниченным числом соседних нуклонов. Поэтому при увеличении в ядре числа нуклонов ядерные силы сцепления значительно ослабевают. Соответственно ядра тяжёлых элементов менее устойчивы.
На преодоление силы, удерживающей нуклоны в ядре, которая называется энергией связи ядра, затрачивается сила на разрушение ядра, которая характеризуется частью количества массы ядра.
Пример расчёта массы ядра:

Для массы ядра гелия она равна:
m = 1,0076 · 2 + 1,0083 · 2 = 4,033 а.е.м.,
а на самом деле она меньше расчётной - 4,030 а.е.м., т.е. своих составляющих, взятых отдельно. Вот эта разница в 0,003 а.е.м. и получила название дефект массы (Δm), который показывает прочность связей нуклонов в ядре и сколько выделилось энергии при синтезе ядра.
Расчёт взаимосвязи между массой и энергией проводится по формуле А.Эйнштейна:
Е = mc²,
т.е. масса и энергия - формы одного явления.
Энергия связи ядра очень велика и соразмерно возрастает с увеличением числа нуклонов: дейтерий  - 2,2 МэВ, гелий
- 2,2 МэВ, гелий  - 28 МэВ, азот -
- 28 МэВ, азот - 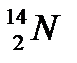 - 104,56 МэВ, уран
- 104,56 МэВ, уран  - 1800 МэВ.
- 1800 МэВ.
В среднем энергия связи на один нуклон примерно составляет 8 МэВ. Для сравнения химическая энергия связи атомов в молекулах в расчёте на один атом равна 2-5 эВ, т.е. в 4-1,6 миллиона раз меньше.
Таким образом, при синтезе или делении ядер атомов и выделяется такое громадное количество энергии.
В последние годы получили своё появление и развитие весьма смелые идеи в теории элементарных частиц, приближающие нас к созданию обобщённой теории, объясняющей построение мира.
По современным представлениям вещество Вселенной состоит из фотонов, лептонов и кварков, а структурно-функциональная организация любой материальной системы определяется их взаимодействиями.
В настоящее время известно более 2000 различных частиц, обнаруженных физиками.
Различают следующие взаимодействия: электромагнитные, сильные, слабые и гравитационные.
Электромагнитные взаимодействия. В них участвуют частицы, имеющие электрический заряд или магнитный момент. Переносчиком его являются фотоны. По силе электромагнитные взаимодействия располагаются между сильными и слабыми и являются дальнодействующими. К ним относятся: упругость, трение, вязкость, химические связи и т.п.
Сильные взаимодействия. Это переносчики ядерных сил. Они связывают кварки в барионы и в мезоны.
Слабые взаимодействия. В них участвуют все элементарные частицы за исключением фотонов. Они неизмеримо сильнее гравитационных. Радиус их действия – 2∙10-16 см. Обусловливают большинство распадов элементарных частиц и взаимодействие нейтрино с веществом.
Гравитационные взаимодействия. Самые слабые, присущие всем видам материи, т.е. универсальные.
Все эти взаимодействия описываются единой теорией, глубоко обобщающей теорию Джеймса Кларка Максвелла (1831-1879) – математическую теорию электромагнетизма.
Однако, несмотря на значительные усилия многих теоретиков, общая единая теория всех взаимодействий пока ещё окончательно не создана.
Радиоактивность
Радиоактивность была открыта в 1896 г. А. Беккерелем, экспериментировавшим с солями урана. А в 1898 г. Пьер Кюри и Мария Склодовская-Кюри открыли два радиоактивных элемента: полоний и радий.
Что же такое радиоактивность? Это способность ядер атомов одних химических элементов превращаться в ядра атомов других химических элементов с выделением энергии, носителями которой являются корпускулы (альфа- и бета-частицы, протоны и нейтроны) и фотоны (гамма-лучи).
Известны 4 типа радиоактивного распада (радиоактивности):
1) альфа-распад,
2) бета-распад,
3) спонтанное деление ядер атомов,
4) протонный распад.
Предсказаны и обоснованы математическими расчётами, но ещё не наблюдались экспериментально:
5) двупротонный распад и
6) двунейтронный распад.
Различают естественную (природную) и искусственную (полученную человеком) радиоактивность, которые подчиняются одним и тем же физическим законам.
Дата добавления: 2016-07-05; просмотров: 2318;











