Титр (Т) - масса растворенного вещества в 1 мл раствора (г/мл).
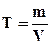 . (6.4)
. (6.4)
Зная эквивалентную концентрацию раствора, титр можно рассчитать по формуле
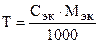 . (6.5)
. (6.5)
6. Моляльность (Сm) - количество (моль) растворенного вещества в одном килограмме чистого растворителя (моль/кг).
Пример 9. Найти молярность, нормальность, моляльность и титр раствора H2SO4 с массовой долей кислоты 15 % (r = 1,1 г/мл).
Решение. Чтобы найти молярность и нормальность раствора, надо найти, сколько вещества растворено в 1 л раствора. По уравнению (6.2):
m (1л) = V·r = 1000·1,1= 1100 г 1100 г раствора - 100 %
х г - 15 %
х = (1100·15) / 100 = 165 г (H2SO4).
М(H2SO4) = 98 г/моль ; Мэк(H2SO4) 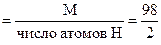 = 49 г/моль экв.
= 49 г/моль экв.
Следовательно, CМ = m / M = 165 / 98 = 1,68 моль/л.
Сэк = m / Mэк = 165 / 49 = 3,37 моль экв/л.
Титр раствора = m/V = 165 / 1000 = 0,165 г/мл.
Для нахождения моляльности раствора найдем массу H2SO4, приходящуюся на 1000 г H2O. 15%-й раствор - это:
85 г Н2О - 15 г H2SO4
1000 г Н2О - х х = 176,5 г.
Следовательно, Сm = 176,5 / 98 = 1,8 (моль/кг).
Пример 10. Для нейтрализации 42 мл H2SO4 потребовалось добавить 14 мл
0,3 Н раствора щелочи. Определить молярность раствора H2SO4.
Решение.Поскольку согласно закону эквивалентов вещества взаимодействуют в эквивалентных количествах, то можно использовать следующее равенство:
Н1·V1 = Н2·V2 (где Н1 и Н2 - нормальности растворов, а V1 и V2 - объемы). Следовательно,
Н к-ты·42 = 0,3·14; отсюда Н к = (0,3·0,14) / 42 = 0,1 Н.
Поскольку Мэк (H2SO4) = М/2, т.е. 0,5 моль, то молярность (СМ) кислоты составляет 0,1·0,5 = 0,05 моль/л.
Дата добавления: 2016-07-05; просмотров: 3980;











