Металлы и неметаллы
1. Металлы
Деление элементов на металлы и неметаллы достаточно условно. Неметаллы располагаются в правом верхнем углу периодической системы в главных подгруппах. Из 107 элементов - 85 металлы. К металлам относят:
1. все s-элементы главных подгрупп, исключая водород и гелий;
2. все d- и f-элементы (т.е. элементы побочных подгрупп);
3. р-элементы 3А группы, за исключением бора;
4. некоторые элементы 4А и 5А групп с большим порядковым номером (олово, свинец, сурьма и висмут).
Физические свойства металлов
Отличия между металлами и неметаллами.
1. Все металлы, исключая ртуть, имеют твердое агрегатное состояние, тогда как неметаллы существуют как в твердом, так и в газообразном или жидком состоянии. Металлы имеют характерные физические свойства - хорошую электро- и теплопроводность, металлический блеск, ковкость. Некоторые металлы имеют магнитные свойства.
2. Атомы металлов на внешнем уровне имеют небольшое число электронов и слабее их удерживают, чем неметаллы. Нейтральные атомы металлов легко отдают электроны, превращаясь в катионы. Отрицательно заряженных ионов металлы не образуют. Неметаллы способны как присоединять, так и отдавать электроны.
3. Металлы в нейтральном состоянии проявляют только восстановительные свойства, тогда как неметаллы в нейтральном состоянии проявляют как окислительные, так и восстановительные свойства в зависимости от партнера по реакции.
4. Неметаллы более склонны к образованию ковалентных связей. Металлы в нейтральном состоянии связаны металлической связью, а в соединениях они образуют ионные или полярные ковалентные связи.
5. Для металлов характерна непрозрачность, поскольку подвижные электроны металла гасят световое излучение, превращая световую энергию в тепловую. В определенных условиях падающий на металл луч может выбивать электроны (фотоэффект).
6. Большинство металлов одинаково отражают свет всех длин волн и имеют серебристый цвет. Только медь и золото поглощают соответственно зеленый и голубой свет, поэтому медь окрашена в красный цвет, а золото в желтый. Неметаллы чаще окрашены в различные цвета, поскольку они способны избирательно поглощать световое излучение различной длины.
7. Металлы имеют хорошую тепло- и электропроводность, что объясняется наличием в металле свободных электронов. Наилучшим проводником является серебро и медь, наихудшим - ртуть. Неметаллы плохо проводят тепло и электричества, некоторые из них полупроводники.
8. Металлы имеют хорошую механическую деформируемость - пластичность, в основе которой лежит способность слоев металла смещаться относительно друг друга без разрушения, так как электронный газ перемещается вслед за ионами металлов. Смещение ионов в кристаллах неметаллов ведет к разрушению, так как при этом могут сближаться одноименно заряженные ионы, что вызывает отталкивание.
9. Плотность металлов колеблется в широких пределах. Металлы с плотностью менее 5 г/см3 называются легкими, а выше этой цифры - тяжелыми. Так, литий имеет плотность 0, 53, алюминий -2, 7, свинец - 11, 3 золото - 19, 3, осмий - 22, 6 г/см3. Простые вещества неметаллов, как правило, имеют небольшую плотность.
10. Различают легкоплавкие металлы; ртуть (-38, 9ºС), цезий (29ºС) и тугоплавкие: железо (1539ºС), хром (1903ºС), вольфрам (3390ºС). Неметаллы, как правило, плавятся при низких температурах.
11. В зависимости от магнитных свойств, различают диамагнитные металлы (выталкиваются магнитным полем - Cu, Au, Zn, Hg и др.), парамагнитные металлы, (втягиваются магнитным полем - Sc, Ti, V, Cr, Mn, W, Pt и др.), ферромагнитные металлы (после пребывания в магнитном поле способны намагничиваться Fe, Co, Ni).
Таким образом, можно заключить, что к металлам относят элементы, обладающие следующим набором свойств: пластичностью, высокой тепло- и электропроводностью, металлическим блеском, твердостью, высокой плотностью.
Особенности свойств переходных металлов (d- и f-элементов)
1. Заполнение электронных оболочек переходных металлов имеет особенности: - последний уровень остается неизменным и имеет конфигурацию s2, а новые электроны поступают на предшествующие d- или f- подуровни. У некоторых элементов (Cr, Cu, Ru, Ro, Pd, Ag и др.) последний s-подуровень содержит не 2 электрона, а только один (проскок электрона).
2. Переходные элементы проявляют переменную степень окисления. В образовании связей участвуют не только электроны последнего уровня, но и предшествующих d- и f-подуровней. Максимальная степень окисления соответствует номеру группы. Лишь у элементов 8В подгруппы - железа, кобальта, никеля она меньше номера группы.
3. Медь, серебро, золото единственные из элементов, проявляющие степень окисления больше номера группы (Cu2+, Au3+).
4. Переходные элементы в низких степенях окисления образуют соединения с ионным типом связей, их оксиды и гидроксиды имеют основной характер. В высоких степенях окисления (+5, +6, +7) они образуют соединения с преимущественно ковалентными связями. Оксиды и гидроксиды с высокими степенями окисления металла имеют кислотный характер.
5. Переходные элементы склонны к комплексообразованию как с нейтральными молекулами - Ni(CO)4, так и ионами - [Fe(CN)6]-4. Они охотно образуют соединения включения, когда небольшие молекулы неметаллов (H2, N2, С) проникают в междуузлия кристаллической решетки.
Внутреннее строение металлов
В узлах кристаллической решетки расположены положительно заряженные ионы, а между ними перемещаются свободные электроны - электронный газ. Переходя от одного положительно заряженного иона к другому, электроны осуществляют связь между всеми ионами, превращая кристалл в единое целое. В кристаллической решетке каждый ион чаще окружен 8-12 другими ионами. Основные типы кристаллических решеток у металлов: объемноцентрированная, гранецентрированная, гексагональная.
Химические свойства металлов
Атомы металлов имеют сравнительно большие размеры и слабо связанные с ядром внешние электроны. Поэтому металлы характеризуются низкой энергией ионизации и легко отдают электроны. Характерным химическим свойством металлов в нейтральном состоянии является восстановительная активность. В то же время ионы металлов могут присоединять электроны и проявляют окислительные свойства. По восстановительной способности металлы располагаются в ряд напряжений Бекетова, который в настоящее время известен как ряд стандартных электродных потенциалов.
Li, Cs, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, H2, Sb, Bi, Cu, Ag, Hg, Os, Au
1. Чем левее в электрохимическом ряду находится металл, тем больше его восстановительные свойства, тем легче он окисляется. Чем правее находится металл, тем меньше его восстановительные свойства, тем труднее он окисляется.
2. Активные металлы вытесняют менее активные из водных растворов или расплавов их солей. В случае водных растворов надо принимать во внимание, что активные металлы (от Li до Zn) взаимодействуют с водой.
CuSO4 + Fe = FeSO4 + Cu
3. Все металлы с отрицательным значением электродного потенциала окисляются ионами водорода, образующимися в результате диссоциации кислот-неокислителей (HCl, H2SO4разб, H2S, H2SO3, H3PO4, HCOOH, CH3COOH) и вытесняют водород из этих кислот. Некоторые металлы пассивируются кислотами из-за образования на их поверхности прочных пленок оксидов или солей. Так, Pb пассивируется разбавленной серной кислотой.
Mg + 2HCl = MgCl2 + H2
2Al + 6HCl = 2AlCl3 + 3H2
4. Наиболее активные металлы (Li, Cs, Rb, K, Ca, Na, Mg, Al, Mn, Zn) на холоду или при нагревании окисляются ионами водорода, которые появляются в результате диссоциации воды (H2O  H+ + OH-). Они разлагают воду с выделением водорода.
H+ + OH-). Они разлагают воду с выделением водорода.
2K + 2H2O = 2KOH + H2
2Al + 6H2O = 2Al(OH)3 + 3H2
5. Металлы, которые стоят между цинком и водородом (Cr, Fe, Ni, Sn, Pb) окисляются только кислотами, но не водой (в воде не хватает ионов водорода).
Fe + 2HCl = FeCl2 + H2
6. Металлы, стоящие в электрохимическом ряду после водорода (Sb, Bi, Cu, Ag, Hg, Os, Au) ни водой, ни кислотами-неокислителями не окисляются.
7. Большинство металлов окисляются кислотами-окислителями (HNO3, HClO, H2SO4конц), исключая Au, Pt и металлы, которые пассивируются этими кислотами. Так, холодная H2SO4конц пассивирует железо и алюминий, а HNO3конц. - железо, алюминий, хром.
Cu + 2H2SO4конц = CuSO4 + SO2 + 2H2O
8. Амфотерные металлы - окисляются также щелочами.
2Al + 2NaOH + 6H2O = 3H2 + 2Na[Al(OH)4];
Zn + 2KOH + 2H2О = H2 + K2[Zn(OH)4];
Sn + 2NaOH + 2H2O = H2 + Na2[Sn(OH)4]
9.Другие свойства металлов
а) Почти все металлы (кроме золота и платиновых металлов) образуют оксиды, а наиболее активные - не только оксиды, но и пероксиды.
б) Активные металлы образуют ионные или ковалентные гидриды (типа NaH, Al2H6), менее активные - соединения включения (твердые растворы)
в) Все металлы образуют соединения с фтором, хлором.
г) Почти все металлы, кроме золота и платиновых металлов, образуют соединения с серой (сульфиды), фосфором (фосфиды), углеродом (карбиды), кремнием (силициды). Щелочные и щелочно-земельные металлы образуют соединения с азотом (нитриды).
д) Активные металлы вытесняют менее активные металлы из оксидов.
3Fe3O4 + 8Al = 9Fe + 4Al2O3, TiO2 + 2Mg = 2MgO + Ti
В самородном виде встречаются лишь немногие металлы (золото, серебро, платина, ртуть, олово). Большинство металлов находятся в виде минералов (руд), из которых эти металлы необходимо извлечь. Руды с малым содержанием металлов, как правило, предварительно обогащают.
А) Пирометаллургия. В её основе лежит восстановление металлов из руд при высоких температурах (pyros - огонь) с помощью восстановителей.
1. Восстановлением углем (коксом) или монооксидом углерода. Применяют для получения чугуна и железа, хрома, цинка, меди и других металлов.
3Fe2O3 + CO = 2Fe3O4 + CO2
Fe3O4 + CO = 3FeO + CO2
FeO + CO = Fe + CO2
FeO + C = Fe + CO
CuO + C = 2Cu + CO
Fe(CrO2)2 + 4CO = Fe + 2Cr + 4CO2
2. Восстановление водородом. Прямое получение стали из обогащенной железной руды, получение дорогих металлов из их оксидов.
CuO + H2 = Cu + H2O;
ZnO + H2 = Zn + H2O;
MoO3 + 3H2 = Mo + 3H2O.
3. Восстановление с помощью алюминия (алюмотермия) и других активных металлов.
3Fe3O4 + 8Al = 9Fe + 4Al2O3
Сr2O3 + 2Al = 2Cr + Al2O3
TiO2 + 2Mg = 2MgO + Ti
V2O5 + 5Ca = 2V + 5CaO
Б) Гидрометаллургия. Базируется на переводе нерастворимых руд металлов в растворимые соединения. Так, нерастворимый оксид меди обрабатывают серной кислотой, а из сульфата меди получают чистую медь, вытесняя ее железом.
CuO + H2SO4 = CuSO4 + H2O
CuSO4 + Fe = FeSO4 + Cu
B) Электрометаллургия. Это получение металлов с помощью электролиза. Так получают алюминий, щелочные и щелочноземельные металлы, очищают металлы от примесей.
2NaCl → 2Na + Cl2
2Al2O3→ 4Al + 3O2
Сплавы- это гомогенные (однородные) смеси расплавленных металлов или продуктов их затвердения. Известно более 800 сплавов. Различают:
-черные сплавы (чугун, стали),
-цветные сплавы (бронза, латунь),
-легкие сплавы (дюралюминий, магналий),
-благородные сплавы (сплавы золото и т.д.)
К собственно сплавам относят твердые растворы и интерметаллические соединения, хотя имеется несколько вариантов взаимодействия металлов друг с другом.
1. Твердые растворы. Такие сплавы образуются из металлов имеющих близкие по размерам радиусы атомов (серебро-золото, платина-золото, медь-никель). Эти металлы смешиваются в любом соотношении в расплавленном состоянии и в любых соотношениях кристаллизуются. В твердых растворах атомы обоих металлов имеют общую кристаллическую решетку.
2. Интерметаллические соединения. Расплавленные металлы взаимодействуют между собой химически и имеют постоянный состав. Например, сплавы CuZn, Ca3Sb2, Na2Pb, NaHg.
3. Металлы смешиваются между собой только в жидком состоянии, а при охлаждении однородного твердого раствора не получается. Твердая масса состоит из мелких кристаллов исходных компонентов. Так, кристаллизуется расплавленная смесь олова и свинца, серебра и свинца.
4. Металлы не растворяются друг в друге (ни в жидком, ни в твердом состоянии) - Zn и Pb, Al и Na.
Примеры сплавов
1. Чугун - сплав железа с углеродом (более 2%) и другими добавками.
2. Сталь - сплав железа с углеродом (менее 2%) и другими добавками.
3. Латунь - сплав меди с цинком (10-50%)
4. Бронза - сплав меди с оловом (до 20%)
5. Константан - сплав меди (60%), никеля (38%), марганца (1-2%)
6. Мельхиор - сплав меди (80%) и никеля (20%)
7. Нихром - сплав никеля (60%), железа (14-18%), хрома (18%)
8. Баббиты - сплав свинца (65%), олова (15-17%) сурьмы (15-17%), меди (2%)
9. Дюралюминий - сплав алюминия (90%), меди (3-5%), магния (4%)
10. Силумин - сплав алюминия (86-88%) и кремния (12-14%)
11. Магналий - сплав алюминия (80-97%) с магнием (3-20%)
2. Неметаллы
Неметаллы- химические элементы, которые образуют простые тела, не обладающие свойствами, характерными для металлов. К неметаллам относят 22 элемента.
Положение неметаллов в периодической системе химических элементов
| Группа Период | I | III | IV | V | VI | VII | VIII |
| I | H | He | |||||
| II | B | C | N | O | F | Ne | |
| III | Si | P | S | Cl | Ar | ||
| IV | As | Se | Br | Kr | |||
| V | Te | I | Xe | ||||
| VI | At | Rn |
Как видно из таблицы, неметаллические элементы в основном расположены в правой верхней части периодической системы.
Строение атомов неметаллов. Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов. Особенно сильные окислительные свойства, т.е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-оми 3-м периодах VI-VII групп. Если сравнить расположение электронов по орбиталям в атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления -1. Самым сильным окислителем является фтор. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали. Благодаря этому распаривание электронов может произойти тремя разными путями. В первом случае хлор может проявить степень окисления +3 и образовать хлористую кислоту HClO2, которой соответствуют соли -хлориты, например хлорит калия KClO2. Во втором случае хлор может образовать соединения, в которых степень окисления хлора +5. К таким соединениям относятся хлорноватая кислотаHClO3 и ее соли-хлораты, например хлорат калия КClO3 (бертолетова соль). В третьем случае хлор проявляет степень окисления +7, например? в хлорной кислоте HClO4 и в ее солях, - перхлоратах (в перхлорате калия КClO4).
Строения молекул неметаллов. Физические свойства неметаллов
В газообразном состоянии при комнатной температуре находятся:·водород - H2, азот - N2, кислород - O2, фтор - F2, хлор - Cl2и инертные газы (гелий - He, неон- Ne, аргон- Ar, криптон- Kr, ксенон- Xe, радон - Rn).
В жидком - бром - Br.
В твердом: бор - B, углерод - C, кремний - Si, фосфор - P, сера - S, мышьяк- As, селен - Se, теллур - Te, йод - I, астат- At.
Гораздо богаче у неметаллов и спектр цветов: красный - у фосфора, бурый - у брома, желтый - у серы, желто-зеленый - у хлора, фиолетовый - у паров йода и т.д.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные- немолекулярное. Этим и объясняется отличие их свойств.
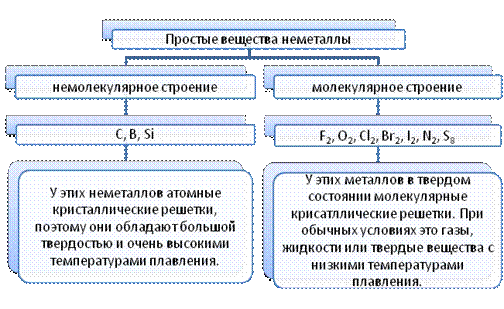
Состав и свойства простых веществ – неметаллов
Неметаллы образуют как одноатомные, так и двухатомные молекулы. К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это H2, F2, Cl2, Br2, Cl2 (элементы VII группы периодической системы), а также кислород O2 и азот N2. Из трехатомных молекул состоит газ озон (O3). Для веществ неметаллов, находящихся в твердом состоянии, составить химическую формулу довольно сложно. Атомы углерода в графите соединены друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов: C, Si, S и т. д. Такие простые вещества, какозони кислород, имеющие одинаковый качественный состав (оба состоят из одного итогоже элемента - кислорода), но различающиеся по числу атомов в молекуле, имеют различные свойства. Так, кислород запаха не имеет, в то время как озон обладает резким запахом, который мы ощущаем во время грозы. Свойства твердых неметаллов, графита и алмаза, имеющих также одинаковый качественный состав, но разное строение, резко отличаются (графит хрупкий, алмаз твердый). Таким образом, свойства вещества определяются не только его качественным составом, но и тем, сколько атомов содержится в молекуле вещества и как они связаны между собой. Неметаллы в виде простых тел находятся в твердом или газообразном состоянии (исключая бром - жидкость). Они не имеют физических свойств, присущих металлам. Твердые неметаллы не обладают характерным для металлов блеском, они обычно хрупки, плохо проводят электрический токи тепло (за исключением графита). Кристаллический бор В (как и кристаллический кремний) обладает очень высокой температурой плавления (2075°С) и большой твердостью. Электрическая проводимость бора с повышением температуры сильно увеличивается, что дает возможность широко применять его в полупроводниковой технике. Добавка бора к стали и к сплавам алюминия, меди, никеля и др. улучшает их механические свойства. Бориды (соединения борас некоторыми металлами, например с титаном: TiB, TiB2) необходимы при изготовлении деталей реактивных двигателей, лопаток газовых турбин. Как видно из схемы, углерод - С, кремний - Si, бор- В имеют сходное строение и обладают некоторыми общими свойствами. Как простые вещества они встречаются в двух видоизменениях - в кристаллическом и аморфном. Кристаллические видоизменения этих элементов очень твердые, с высокими температурами плавления. Кристаллический кремний обладает полупроводниковыми свойствами. Все эти элементы образуют соединения с металлами - карбиды, силицидыибориды (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Некоторые из них обладают большей твердостью, например Fe3C, TiB. Карбид кальция используется для получения ацетилена.
Химические свойства неметаллов. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличивается в следующем порядке: Si, B, H, P, C, S, I, N, Cl, O, F.
Неметаллы как окислители
Окислительные свойства неметаллов проявляются при их взаимодействии:
-с металлами: 2Na + Cl2 = 2NaCl;
-с водородом: H2 + F2 = 2HF;
-с неметаллами, которые имеют более низкую электроотрицательность: 2Р + 5S = Р2S5;
-с некоторыми сложными веществами: 4NH3 + 5O2 = 4NO + 6H2O, 2FeCl2 + Cl2 = 2 FeCl3.
Неметаллы как восстановители
1.Все неметаллы (кроме фтора) проявляют восстановительные свойства при взаимодействии с кислородом: S + O2 = SO2, 2H2 + O2 = 2H2О.
Кислород в соединении с фтором может проявлять и положительную степень окисления, т.е. являться восстановителем. Все остальные неметаллы проявляют восстановительные свойства. Так, например, хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl2O, ClO2, Cl2O2), в которых хлор проявляет положительную степень окисления. Азот при высокой температуре непосредственно соединяется с кислородом и проявляет восстановительные свойства. Еще легче с кислородом реагирует сера.
2.Многие неметаллы проявляют восстановительные свойства при взаимодействии со сложными веществами:
ZnO + C = Zn + CO
S + 6HNO3конц = H2SO4 + 6NO2 + 2H2О.
3.Существуют и такие реакции, в которыходинитотже неметалл является одновременно и окислителем и восстановителем:
Cl2 + H2О = HCl + HClO.
4.Фтор - самый типичный неметалл, которому нехарактерны восстановительные свойства, т.е. способность отдавать электроны в химических реакциях.
Соединения неметаллов
Неметаллы могут образовывать соединения с разными внутримолекулярными связями.
С металлами водородобразует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их температуры плавления сравнительно высоки. С неметаллами водород образует летучие соединения молекулярного строения (например, фтороводород HF, сероводород H2S, аммиак NH3, метан CH4). В обычных условиях это газы или летучие жидкости. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HBr, HI, H2S, H2Se, H2Te. При растворении в воде аммиака образуются аммиачная вода, обычно обозначаемая формулой NH4OH и называемая гидроксидом аммония. Ее также обозначают формулой NH3∙H2O и называют гидратом аммиака.
С кислородом неметаллы образуют кислотные оксиды. В одних оксидахони проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других - более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3.
Характеристики кислородных соединений неметаллов
1. Свойства высших оксидов (т.е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
2. В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
3.Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
4.В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
Строение атомов галогенов. К галогенам относятся элементы VIII группы периодической системы, атомы этих элементов содержат на внешнем энергетическом уровне семь электронов и до его завершения им недостает только одного электрона, поэтому галогены проявляют яркие окислительные свойства. В подгруппе с увеличением порядкового номера эти свойства уменьшаются в связи с увеличением радиуса атомов: от фтора к астату - и, соответственно, возрастают восстановительные свойства их. Аналогично уменьшается и значение относительной электроотрицательности галогенов. Как наиболее электроотрицательный элемент, фтор в соединениях с другими элементами проявляет постоянную степень окисления-1. Остальные галогены могут проявлять как эту степень окисления в соединениях с металлами, водородом и менее электроотрицательными элементами, так и положительные нечетные степени окисления от+1до+7в соединениях с более электроотрицательными элементами: кислородом, фтором.
Простые вещества галогены и их свойства. Характеризуя простые вещества - галогены, необходимо вспомнить основные теоретические сведения о типах химической связи и кристаллическом строении вещества. В двухатомных молекулах галогенов атомы связаны ковалентной неполярной связью и имеют молекулярную кристаллическую решетку.
При обычных условияхF2- ярко-желтый, с оранжевым оттенком газ, Cl2- желто-зеленый ядовитый газ с характерным удушливым запахом, Br2- легколетучая бурая жидкость (пары брома сильно ядовиты, ожоги бромом очень болезненны и долго не заживают), аI2- твердое кристаллическое вещество, способное к возгонке. В рядуF2, Сl2, Br2, I2-плотность простых веществ растет, а интенсивность окраски увеличивается. Следовательно, в изменении свойств атомов и простых веществ - галогенов проявляется одинаковая закономерность: с увеличением порядкового номера неметаллические свойства ослабевают, а металлические - усиливаются.
Химические свойства галогенов. 1.Взаимодействие галогенов с металлами с образованием галогенидов:
2Na + I2→ 2NaI (иодиднатрия);
2Al + 3I2→ 2АlI3 (иодид алюминия);
2Al + 3Br2→ 2AlBr3(бромид алюминия).
При реакциях металлов побочных подгрупп (переходных металлов) с галогенами образуются галогениды с большой степенью окисления металла, например:
2Fe + 3Cl2 = 2FеCl3,
2НСl + Fe = FeCl2 + Н2.
2. Взаимодействие галогенов с водородом с образованием галогеноводородов (тип связи - ковалентная полярная, тип решетки - молекулярная). Сравнение скорости химических реакций разных галогенов с водородом позволяет повторить зависимость ее от природы реагирующих веществ. Так, фтор имеет настолько большую скорость реакции, что взаимодействует с водородом с взрывом даже в темноте. Реакция хлора с водородом при обычных условиях идет медленно и лишь при поджигании или освещении скорость ее растет во много раз (происходит взрыв). Еще медленнее взаимодействуют с водородом бром и йод, причем последняя реакция приобретает уже эндотермический характер:
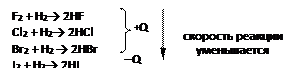

Только фтор взаимодействует с водородом необратимо, остальныегалогеныв зависимости от условий могут давать и обратимую реакцию.
Водные растворы галогеноводородов являются кислотами: HF - фтороводородная (плавиковая), HCl - хлороводородная (соляная), HBr - бромоводородная, HI - йодоводородная.
3.Галогены взаимодействуют с водой:
2F2 + 2Н2O = 4HF + O2
Водавофторегорит, кислород является не причиной, а следствием горения, выступая в непривычной для него роли восстановителя.
4.Для характеристики способности одних галогенов (не атомов галогенов, а простых веществ) к вытеснению других из растворов их соединений можно использовать «ряд активности» галогенов, который записывается так:
F2> Сl2> Вr2> I2,
т. е. окислительные свойства уменьшаются.
Так, хлор вытесняет бром и йод (но нефтор), а бром в состоянии вытеснить только йод из растворов соответствующих солей:
2NaBr + Cl2 = 2NаСl + Br2
2КI + Br2 = 2КВr + I2.
Биологическое значение и применение галогенов. Фтор играет очень важную роль в жизни растений, животных и человека. Без фтора невозможно развитие костного скелета и особенно зубов. Содержание фтора в костях составляет 80-100 мг на 100 г сухого вещества. В эмали фтор присутствует в виде соединения Ca4F2(PO4)2 и придает ей твердость и белизну. При недостатке фтора в организме человека происходит поражение зубной ткани (кариес), а избыток его способствует заболеванию зубов флюорозом. Суточная потребность человека во фторе – 2-3 мг.
Хлор(хлор-ион) более важен для жизнедеятельности животных и человека, чем для растений. Он входит в состав почек, легких, селезенки, крови, слюны, хрящей, волос. Ионы хлора регулируют буферную систему крови. Хлорид натрия является составной частью плазмы крови и спинномозговой жидкости и участвует в регуляции водного обмена в организме. Свободная соляная кислота входит в состав желудочного сока всех млекопитающих и активно участвует в пищеварении. У здорового человека содержится в желудке 0, 2-0, 3% соляной кислоты. Недостаток хлора в организме приводит к тахикардии, снижению артериального давления, судорогам. Достаточное количество хлора содержится в таких овощах как сельдерей, редис, огурцы, капуста белокочанная, укроп, перец, лук, артишок.
Бром также входит в число необходимых микроэлементов и больше всего его содержится в гипофизе, крови. Щитовидной железе, надпочечниках. Бромиды в небольших дозах (0, 1-0, 3 взрослого человека) положительно действуют не центральную нервную систему как усилители процессов торможения в коре головного мозга. В природе бромиды накапливаются в таких растениях, как рожь, пшеница, ячмень, картофель, морковь, черешня, яблоки. Много брома содержится в голландском сыре.
Йод в организме человека начинает накапливаться еще в утробе матери. В гормоне щитовидной железы человека - тироксине - содержится 60% связанного йода. Этот гормон с током крови поступает в печень, почки, молочные железы, желудочно-кишечный тракт. Недостаток йода в организме человека вызывает такие заболевания, как эндемический зобикретинизм, при котором замедляется рост и развивается умственная отсталость. В сочетании с другими элементами йод способствует росту и упитанности животных, улучшает их здоровье и плодовитость. Основными поставщиками йода для человека служат злаки, баклажаны, фасоль, капуста белокочанная и цветная, картофель, лук, морковь, огурцы, тыква, салат, морская капуста, кальмары.
Общая характеристика халькогенов. В главной подгруппе шестой группы периодической системы элементов Д. И. Менделеева находятся элементы: кислород (О), сера (S), селен (Se), теллур(Te) иполоний (Po). Эти элементы имеют общее название халькогены, что означает «образующие руды».
В подгруппе халькогенов сверху вниз с увеличением заряда атома закономерно изменяются свойства элементов: уменьшается их неметаллический характер и усиливаются металлические свойства. Таккислород- типичный неметалл, а полоний - металл (радиоактивен).
| Сравнительные характеристики | Кислород (8О) | Сера (16S) |
| Электронное строение | 1s22s22p4 | …3s23s4 |
| Степеньокисления | -1, -2, +2* * - только в оксиде F2O | -2, +2, +4, +6 |
| Нахождение в природе | В свободном состоянии - в атмосфере (О2- кислород, О3- озон), в связанном - в составеН2О, SiO2, в сложных соединениях | Самородная сера;сульфиды: свинцовыйблескPbS, медный блескСu2S, пиритFeS2, сероводородH2S;сульфаты:гипсCaSO4∙2H2O, горькая сольMgSO4∙7H2O, белки |
| Физические свойства | О2- бесцветный газ без вкуса и запаха, умеренно растворим в воде, парамагнитен. O3- газ синего цвета, диамагнитен, сильный окислитель | S-ромбическая- желтые хрупкиекристаллыбез запаха, не растворима в воде, ρ = 2 г/см3; S-пластическая - коричнево-желтая, резиноподобная |
| Химические свойства | По активности уступает только фтору, реагирует со всеми простыми веществами, (исключение: галогены, Pt, Au, инертные газы) и со многими сложными веществами | И окислительные, и восстановительные свойства |
| Получение | Фракционнаяперегонкажидкого воздуха; в лаборатории - при термическом разложении CrO3, KNO3, KClO3, BaO2 | В промышленности: из самородных руд. В лаборатории: окислением сероводорода, сульфидов |
| Применение | Для получения серной и азотной кислот; для выплавки чугуна и стали; для резки и сварки металла; как окислитель ракетного топлива; в органическом синтезе. | Для получения серной кислоты; в сельском хозяйстве для борьбы с вредителями; производство спичек;вулканизациякаучука; в производстве черногопороха. |
Биологическая роль халькогенов. Сера играет важную роль в жизни растений, животных и человека. В животных организмах сера входит в состав почти всех белков, в серосодержащие аминокислоты - цистеиниметионин, а также в состав витамина В1 и гормона инсулина. При недостатке серы у овец замедляется рост шерсти, а у птиц отмечена плохая оперяемость.
Из растений больше всего потребляют серу капуста, салат, шпинат. Богаты серой также стручки гороха и фасоли, брюква, редис, репа, лук, хрен, тыква, огурцы; бедны серой арбузикрасная свекла.
По химическим свойствам селен и теллур очень похожи на серу, но по физиологическим являются ее антагонистами. Для нормального функционирования организма необходимы очень малые количества селена. Селен положительно влияет на состояние сердечнососудистой системы, образование красных кровяных телец, повышает иммунные свойства организма. Повышенное количество селена вызывает у животных заболевание, проявляющееся в исхудании и сонливости. Недостаток селена в организме ведет к нарушению работы сердца, органов дыхания, повышается температура тела и может даже наступить смерть. Существенное влияние селен оказывает на зрение животных. Например, у оленей, которые отличаются высокой остротой зрения, в сетчатке глазселена содержится в 100 раз больше, чем в других частях тела. В растительном мире много селена содержат все бобовые растения. Особенно большое его количество накапливает растение астрагал.
Физиологическая роль теллура для растений, животных и человека изучена меньше, чем селена. Известно, что теллур менее токсичен по сравнению с селеном и соединения теллура в организме быстро восстанавливаются до элементарного теллура, который в свою очередь соединяется с органическими веществами.
Общая характеристика элементов подгруппы азота. В главную подгруппу пятой группы входят азот (N), фосфор (P), мышьяк (As), сурьма (Sb) ивисмут(Bi).
Сверху вниз в подгруппе от азота к висмуту неметаллические свойства уменьшаются, а металлические свойства и радиус атомов - увеличиваются. Азот, фосфор, мышьяк являются неметаллами, асурьмаотносится к металлам.
| Сравнительные характеристики | Азот (7N) | Фосфор (15Р) | Мышьяк (33As) |
| Электронное строение | 1s22s22p3 | …3s23p3 | …3d104s24p3 |
| Степень окисления | -1, -2, -3, +1, +2, +3, +4, +5 | -3, +1, +3, +4, +5 | -3, +3, +5 |
| Электроотрицательность | 3, 07 | 2, 10 | 2, 20 |
| Нахождение в природе | В свободном состоянии - в атмосфере (N2-азот), в связанном - в составе NaNO3-чилийская селитра; КNO3- индийская селитра | Ca3(РО4)2- фосфорит, Ca5(РО4)3(ОН) - гидрооксилапатит, Ca5(РО4)3F - фторапатит | As2S3-аурипигмент, As4S4-рельгар, FeAsS -арсенопирит |
| Содержание в земной коре, массоваядоля, % | 0, 04 | 8, 0·10-2 | 5·10-4 |
| Аллотропические формы при обычных условиях | Азот (одна форма) | Белый, красный, черный фосфор | Металлический (серый) мышьяк |
| Агрегатное состояние | Газ | Кристаллические вещества | Металлоподобное кристаллическое вещество |
Важнейшие формы кислотных оксидов элементов этой подгруппы Э2О3 и Э2О5, им соответствуют кислоты НЭО2 или Н3ЭО3, и НЭО2 или Н3ЭО4.
Элементы подгруппы азота образуют газообразные водородные соединения (NH3-аммиак, РН3-фосфин).
Водные растворы аммиака и фосфина представляют собой слабые основания:
NH3 + Н2О ↔ NH4ОН ↔ NH4+ + ОН– (гидроксид аммония);
РH3 + Н2О ↔ РH4ОН ↔ РH4+ + ОН- (гидроксид фосфония).
Биологическая роль азота и фосфора. Азот играет исключительно важную роль в жизни растений, поскольку входит в состав аминокислот, белков и хлорофилла, витаминов группы В, ферментов, активизирующих обмен веществ. Поэтому недостаток азота в почве отрицательно сказывается на растениях, и в первую очередь на содержание хлорофилла в листьях, из-за чего они бледнеют. Овощные растения потребляют от 50 до 250 кг азота на 1 гектар площади почвы. Больше всего азота находится в цветах, молодых листьях и плодах. Важнейшим источником азота для растений являются азотные удобрения-
| <== предыдущая лекция | | | следующая лекция ==> |
| Все орхидные вступают в симбиоз с микоризообразующими грибами, которые поставляют растению воду и минеральные соли, получая взамен органические вещества. | | | Мониторинг состояния биосферы |
Дата добавления: 2020-06-09; просмотров: 1128;











