Кислоты также вступают в реакцию обмена с оксидами металлов.
В результате реакции образуется соль и вода.
Кислота + оксид металла = соль + вода
Поместим в пробирку оксид металла – оксид меди (II), он чёрного цвета, нальём в эту же пробирку раствор серной кислоты и слегка нагреем содержимое пробирки.
У нас протекает реакция, в результате которой образуется соль – сульфат меди (II) и вода. Доказать, что в реакции образовалась соль можно так же, как и в предыдущих опытах, для этого следует несколько капель раствора поместить на предметное стекло и выпарить.
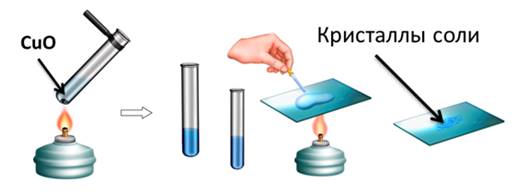
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+ = Cu2+ + H2O
Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для того чтобы реакция между кислотой и металлом прошла, необходимы следующие условия:
· Металл должен находиться в ряду напряжений до водорода.
· Должна получиться растворимая соль.
· Нерастворимые кислоты не вступают в реакцию с металлами.
· Концентрированный раствор серной и растворы азотной кислоты иначе реагируют с металлами.
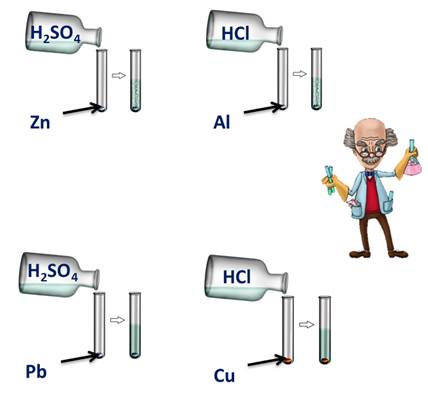
Для этого подтверждения поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую – алюминий, в третью – свинец, четвёртую – медь.
В первую и третью пробирку нальём раствора серной кислоты, во вторую и четвёртую – раствора соляной кислоты. Понаблюдаем за изменениями.
В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет.
В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой.
В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn + H2SO4 = ZnSO4 + H2↑
Zn0 + 2H+ = Zn2+ + H20↑
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al0 + 6H+ = 2Al3+ + 3H20↑
Pb + H2SO4 ≠
Cu + HCl ≠
Реакция кислот с солями относится к реакциям обмена,
при этом образуется новая кислота и новая соль.
Эти реакции протекают в том случае, если образуется осадок или газ.

Кислота + соль = новая кислота + новая соль
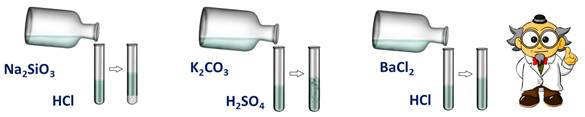
Проведём опыт: для этого в первую пробирку нальём соляной кислоты и силиката натрия, во вторую – серной кислоты и карбоната калия, в третью – соляной кислоты и хлорида бария.
Посмотрим за изменениями: в первой пробирке мы наблюдаем образование студенистого осадка, во второй – выделение газа, а в третьей – изменений нет.
В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
2HCl + Na2SiO3 = 2NaCl + H2SiO3↓
2H+ + SiO32- = H2SiO3↓
H2SO4 + K2CO3 = K2SO4 + CO2↑ + H2O
2H+ + CO32- = CO2↑ + H2O
HCl + BaCl2 ≠
Подведем итог.
Кислоты изменяют окраску индикаторов, реагируют с основаниями, оксидами металлов, при определённых условиях реагируют с металлами и солями.
Дата добавления: 2020-06-09; просмотров: 791;











