Едкие щелочи и аммиак
Из щелочей токсикологическое значение имеют гидроксид калия, гидроксид натрия и аммиак. Отравления другими щелочами встречаются относительно редко.
Доказательством отравлений едкими щелочами является ярко выраженная щелочная реакция водных вытяжек из биологического материала и наличие в них катионов соответствующих металлов. Щелочность среды определяют при помощи фенолфталеина, который изменяет окраску при рН = 8...10. Изменение окраски фенолфталеина происходит не только под влиянием едких щелочей, но и под влиянием карбонатов щелочных металлов, при гидролизе которых образуются едкие щелочи. Поэтому при исследовании вытяжек на наличие едких щелочей в них проверяют рН и присутствие карбонатов щелочных металлов.
К части водной вытяжки из биологического материала прибавляют несколько капель 5 %-го раствора хлорида бария и 2— 3 капли спиртового раствора фенолфталеина. При наличии карбонатов щелочных металлов в вытяжках выпадает белый осадок ВаСО 3 и исчезает розовое или красное окрашивание раствора (окраска фенолфталеина). Если в вытяжках содержатся едкие щелочи и отсутствуют карбонаты, то после прибавления раствора хлорида бария не появляется осадок, но сохраняется красная или розовая окраска вытяжек. При наличии в водных вытяжках смеси карбонатов щелочных металлов и едких щелочей после прибавления раствора хлорида бария образуется белый осадок ВаСО 3 и сохраняется розовая или красная окраска вытяжек.
Выделение едких щелочей из биологического материала. Исследуемые объекты измельчают, заливают дистиллированной водой и настаивают 2—3 ч. Затем смесь воды и измельченного объекта фильтруют. К фильтрату прибавляют 2—3 капли спиртового раствора фенолфталеина. Появление розовой или красной окраски указывает на наличие едких щелочей или карбонатов щелочных металлов в вытяжках. После этого исследуют вытяжки на наличие карбонатов щелочных металлов (реакция с хлоридом бария) и на присутствие в них катионов калия, натрия и аммония.
ГИДРОКСИД КАЛИЯ
Все объявления
ЯндексДирект
Дать объявление
- Низкотемпературные камеры
низкотемпературные морозильники с температурным режимом -24С, -55С, -85С
Адрес и телефон · www.winecoolers.ru
Ярко выраженная щелочная реакция водных вытяжек из биологического материала или диализатов, отсутствие карбонатов и присутствие в вытяжках ионов калия указывают на наличие гидроксида калия в биологическом материале.
Для обнаружения ионов калия в диализатах применяют реакции с гидротартратом натрия NaНС 4 Н 4 О 6 и с кобальтинитритом натрия Na 3 [Co(NO 2 ) 6 ]. Эти реактивы в нейтральных или слабокислых растворах с ионами калия дают осадки.
Поскольку оба реактива с ионами калия дают осадки в нейтральной или слабокислой среде, диализаты, имеющие щелочную реакцию, нейтрализуют или доводят до слабокислой реакции (рН = 3...4) раствором уксусной кислоты. После этого приступают к обнаружению ионов калия в диализатах.
Реакция с гидротартратом натрия. Гидротартрат натрия в нейтральных или уксусно-кислых растворах с ионами калия дает белый кристаллический осадок КНС4Н4О6.
Этот осадок растворяется в горячей воде, минеральных кислотах и щелочах. Потирание стенок пробирки стеклянной палочкой ускоряет выпадение осадка.
Выполнение реакции. В маленькую пробирку вносят 3—5 капель исследуемого диализата, прибавляют 3—4 капли 1 н. раствора гидротартрата натрия или такой же объем смеси равных количеств 2 н. раствора винной кислоты и 2 н. раствора ацетата натрия. Стенки пробирки осторожно потирают стеклянной палочкой. В присутствии ионов калия выпадает белый кристаллический осадок. Реакции мешают ионы аммония, которые с гидротартратом натрия тоже дают осадок.
Реакция с кобальтинитритом натрия. Кобальтинитрит натрия Na 3 [Co(NO 2 ) 6 ] из нейтральных или слабокислых растворов осаждает ионы калия в виде желтого кристаллического осадка K 2 Na[Co(NO 2 ) 6 ].
В сильнокислой среде происходит разложение реактива с образованием нестойкой кислоты Н 3 [Со(]МО 2 ) 6 ], а в щелочной среде при разложении реактива образуется осадок Со(ОН) 3. Потирание стенок пробирки стеклянной палочкой ускоряет выпадение осадка. Реактив должен быть свежеприготовленным.
Выполнение реакции. 3—5 капель исследуемого диализата вносят в маленькую пробирку и прибавляют 2—3 капли раствора кобальтинитрита натрия. Выпадение желтого осадка указывает на наличие ионов калия в диализате. Реакции мешают ионы аммония, иодиды и некоторые восстановители.
Приготовление реактива (см. Приложение 1, реактив 20).
ГИДРОКСИД НАТРИЯ
Все объявления
ЯндексДирект
Дать объявление
- Низкотемпературные камеры
низкотемпературные морозильники с температурным режимом -24С, -55С, -85С
Адрес и телефон · www.winecoolers.ru
При отравлении гидроксидом натрия водные вытяжки из биологического материала или диализаты имеют ярко выраженную щелочную реакцию и в них содержатся ионы натрия.
Наличие ионов натрия в диализатах определяют при помощи реакций с гидроксостибиатом калия (антимонатом калия) и с цинк-уранилацетатом.
Реакция с гидроксостибиатом калия. Одним из реактивов на ионы натрия является гидроксостибиат калия, которому в литературе приписывается несколько формул: KSbO 3 ·3H 2 O, KH 2 SbO 4, K[Sb(OH) 6 ].
Этот реактив в нейтральной или слабощелочной среде с ионами натрия дает белый кристаллический осадок Na[Sb(OH) 6 ].
Осадок гидроксостибиата (антимоната) натрия растворяется в горячей воде и в щелочах. В кислой среде происходит разложение реактива с образованием аморфного осадка метасурьмяной кислоты HSbO 3.
Выпадение осадка метасурьмяной кислоты может привести к ошибочному заключению, так как осадок HSbO 3 можно принять за осадок Na[Sb(OH) 6 ]. Поэтому реакция с гидроксостибиатом калия на ионы натрия должна выполняться в нейтральной среде. Щелочные растворы нейтрализуют уксусной кислотой. Потирание стенок пробирки стеклянной палочкой ускоряет выпадение осадка.
Выполнение реакции. К 3—5 каплям диализата, нейтрализованного уксусной кислотой, прибавляют 2—3 капли раствора гидроксостибиата калия. Стенки пробирки потирают стеклянной палочкой. Выпадение белого кристаллического осадка указывает на наличие ионов натрия в вытяжке.
При малой концентрации ионов натрия осадок может появиться только через некоторое время. Поэтому растворы, содержащие малые количества ионов натрия, предварительно концентрируют упариванием. Реакции мешают ионы аммония, магния, лития и др. В присутствии ионов аммония выпадает осадок НSbО 3, а в присутствии ионов магния и лития — белые осадки антимонатов этих ионов.
Приготовление реактива (см. Приложение 1, реактив 9). Реакция с цинк-уранилацетатом. Уранилацетат UO 2 (СН 3 СОО) 2 в нейтральных или уксусно-кислых растворах с солями натрия дает зеленовато-желтый кристаллический осадок NaUO 2 (CH 3 COO) 3.
Чувствительность этой реакции повышается в присутствии ионов цинка или магния. Поэтому в качестве реактива на ионы натрия применяют раствор цинк-уранилацетата Zn(UO 2 ) 3 (СН 3 COO) 8. Этот реактив с ионами натрия образует кристаллический осадок NaZn(UO 2 ) 3 (СН 3 СОО) 9.
Выполнение реакции. Реакцию на ионы натрия можно выполнять в пробирке и на предметном стекле. Для выполнения этой реакции применяют диализат, нейтрализованный уксусной кислотой.
1. 3—4 капли диализата вносят в пробирку, прибавляют 8— 10 капель раствора цинк-уранилацетата. Появление зеленовато-желтого осадка указывает на наличие ионов натрия в диализате.
2. На предметное стекло наносят каплю диализата, который выпаривают досуха. После охлаждения стекла рядом с сухим остатком наносят 1—2 капли раствора цинк-уранилацетата. Концом заостренной стеклянной палочки реактив надвигают на сухой остаток. При наличии ионов натрия образуются светло-желтые или зеленовато-желтые кристаллы, имеющие форму тетраэдров или октаэдров.
Ионы аммония и калия мешают этой реакции тогда, когда их концентрация в 20 раз больше концентрации ионов натрия. Этой реакции также мешают арсенаты и фосфаты, которые разлагают реактив и дают фосфат или арсенат цинка.
Приготовление реактива (см. Приложение 1, реактив 62).
АММИАК
Основанием для заключения об отравлении аммиаком является ярко выраженная щелочная реакция (по фенолфталеину) водной вытяжки из органов трупов и наличие в этой вытяжке ионов аммония.
Однако обнаружение аммиака в биологическом материале не всегда позволяет сделать вывод об отравлении этим препаратом. Это объясняется тем, что при гниении органов трупов и других объектов биологического происхождения всегда образуются определенные количества аммиака. Кроме аммиака при гниении биологического материала образуется сероводород и ряд других веществ.
Поэтому прежде чем приступить к исследованию водных вытяжек из биологического материала или диализатов на наличие аммиака, химик-эксперт должен проверить эти жидкости на присутствие сероводорода как одного из продуктов гниения белковых веществ. Обнаружение сероводорода в вытяжках из биологического материала указывает на протекание процессов гниения исследуемых объектов, в результате чего образуется как сероводород, так и аммиак. Поэтому при наличии сероводорода в биологическом материале эти объекты на присутствие аммиака не исследуют. На присутствие аммиака подвергают анализу только те органы трупов, которые не подверглись гнилостным изменениям и не содержат сероводорода.
Обнаружение сероводорода.3—5 мл вытяжки из биологического материала или диализата вносят в колбу вместимостью 50 мл, в которую прибавляют 10 %-й раствор соляной кислоты до кислой реакции на лакмус. Колбу сразу же закрывают пробкой, в прорезы на нижней поверхности которой вставлена полоска фильтровальной бумаги, смоченная раствором ацетата свинца. При наличии сероводорода образуется сульфид свинца, в результате чего бумага чернеет.
Приготовление бумаги, смоченной ацетатом свинца (см. Приложение 1, реактив 5).
Реакция с сульфатом меди и лакмусом. В колбу вместимостью 50 мл вносят 10—15 мл водной вытяжки из биологического материала или диализата. Колбу закрывают пробкой, на нижней поверхности которой в прорезы вставляют две индикаторные бумажки (влажная красная лакмусовая бумажка и бумажка, смоченная раствором сульфата меди). Посинение лакмусовой бумажки и бумажки, смоченной раствором сульфата меди (образуется [Cu(NH 3 ) 4 ]SO 4 ), указывает на наличие аммиака в вытяжке из биологического материала. Нагревание колбы на водяной бане ускоряет изменение окраски индикаторных бумажек.
Реакция с реактивом Несслера.От прибавления реактива Несслера к диализату или щелочной водной вытяжке из биологического материала, содержащей аммиак, выпадает осадок иодида дииододимеркураммония:
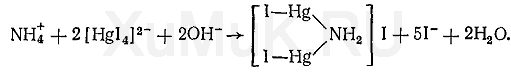
Выполнение реакции. В пробирку вносят 1—2 капли исследуемой вытяжки или диализата, прибавляют 3—5 капель воды и 3—4 капли реактива Несслера. В присутствии аммиака выпадает желто-бурый или оранжево-коричневый осадок. Реакции мешают ионы железа (III) и другие ионы, которые со щелочами дают осадки, а также ионы ртути (II), сурьмы (III), олова (II), которые реагируют с ионами иода и разрушают реактив Несслера.
Приготовление реактива Несслера (см. Приложение 1, реактив 40).
Дата добавления: 2016-06-29; просмотров: 3867;











