Обнаружение фенацетина по УФ- и ИК-спектрам.
Раствор фенацетина в этиловом спирте имеет максимум поглощения при 250 нм; В ИК-области спектра фенацетин (диск с бромидом калия) имеет основные пики при 1243, 1655, 1513 и 1555 см -1.
Предварительная проба на наличие фенацетина в моче.Эта проба основана на том, что фенацетин и его метаболит парацетамол в организме подвергаются биотрансформации, в результате которой образуется п -аминофенол. По наличию п -аминофенола и моче делают вывод о том, что лицом, моча которого подвергается исследованию, был принят фенацетин или парацетамол.
Эта предварительная проба выполняется таким образом: к 1 мл мочи прибавляют 2—3 капли 10% -го раствора соляной кислоты и охлаждают. Затем к охлажденной смеси прибавляют 2—3 капли 1 %-го раствора нитрита натрия и 2—3 капли 1 %-го свежеприготовленного раствора α-нафтола в 10%-м растворе гидроксида натрия. Появление красной окраски указывает на наличие п -аминофенола в моче. Большой избыток α-нафтола мешает этой реакции.
ВЕЩЕСТВА, ЭКСТРАГИРУЕМЫЕ ОРГАНИЧЕСКИМИ РАСТВОРИТЕЛЯМИ ИЗ ПОДЩЕЛОЧЕННЫХ ВОДНЫХ ВЫТЯЖЕК
В химико-токсикологическом анализе наиболее многочисленную группу токсических соединений составляют вещества, которые экстрагируются органическими растворителями из подщелоченных водных вытяжек. Ниже приводится описание свойств, применения и методов анализа только некоторых из этих веществ, которые неоднократно были причиной отравлений.
К числу рассматриваемых ниже веществ относятся алкалоиды, синтетические соединения, полученные на основе алкалоидов, и ряд других препаратов.
Включенные в этот раздел алкалоиды являются производными хинолина (хинин), изохинолина (морфин, кодеин, папаверин, галантамин), пиридина (анабазин, никотин, ареколин), пиперидина (кониин), тропана (атропин, скополамин, кокаин), индола (стрихнин, бруцин, резерпин) и др.
В этот раздел книги включены синтетические вещества, полученные на основе морфина (апоморфин, дионин, героин), препараты, являющиеся производными фенотиазина (аминазин, ди-празин и др.), бензодиазепина (хлордиазепоксид, диазепам, нитразепам), анилина (новокаин и дикаин) и др.
Обнаружение приведенных выше токсических веществ производят в хлороформных вытяжках из подщелоченных водных вытяжек. Для этой цели также могут быть использованы сухие остатки, полученные после выпаривания хлороформных вытяжек, или растворы сухих остатков.
ХИНИН
Хинин является алкалоидом, содержащимся в коре различных видов хинного дерева. В этой коре кроме хинина содержится хинидин, цинхонин, цинхонидин и ряд других алкалоидов. В состав молекулы хинина входят хинолиновый и хинуклидиновый циклы, связанные группой атомов — СН — ОН. Хинин является изомером хинидина. В медицинской практике применяются гидрохлорид, дигидрохлорид и сульфат хинина. Основание хинина растворяется в этиловом спирте (1:1), хлороформе (1 : 3), диэтиловом эфире, насыщенном водой (1 :4), слабо растворяется в воде. Гидрохлорид хинина растворяется в этиловом спирте (1:1), хлороформе (1:2), воде (1 : 23), слабо растворяется в диэтиловом эфире. Сульфат хинина растворяется в этиловом спирте (1 :95), слабо растворяется в воде (1 : 810), диэтиловом эфире и хлороформе.
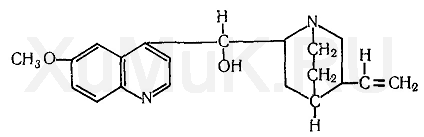
Хинин экстрагируется органическими растворителями из щелочных водных растворов. Максимальные количества хинина экстрагируются хлороформом при рН = 9...10.
Применение. Действие на организм. В зависимости от принятой дозы хинина он может вызывать угнетение центральной нервной системы, головную боль, головокружение, нарушение зрения. Хинин возбуждает мускулатуру матки и усиливает ее сокращение. Он так же вызывает сокращение селезенки. Хинин действует на возбудителя малярии и является одним из эффективных противомалярийных лекарственных препаратов. Его применяют при аритмиях. Хинин применяется в акушерской практике для возбуждения и усиления родовой деятельности. При передозировке хинина, применяемого беременными женщинами, может наступить аборт.
Метаболизм. В организме хинин подвергается метаболизму путем окисления хинолинового и хинуклидинового циклов. При этом образуются 2-оксихинин, 2'-оксихинин, диоксихинин. При метаболизме может окисляться винильная группа в молекуле хинина с образованием хинетина. Также может окисляться хинуклидиновый цикл с образованием гемохинной кислоты (6-метокси-хинолин-4-кетокарбоновой кислоты). Метаболиты и незначительная часть несвязанного хинина выводится из организма с мочой.
Обнаружение хинина
Предварительная проба на наличие хинина в моче. В делительную воронку вносят 2 мл мочи, которую подщелачивают раствором аммиака, а затем прибавляют 4 мл хлороформа и взбалтывают в течение 5 мин. От водной фазы отделяют слой органического растворителя, который взбалтывают с 3 мл 10 %-го раствора серной кислоты. Синяя флуоресценция водной фазы указывает на наличие хинина в моче. Флуоресценция становится более выраженной, если кислую водную вытяжку облучать УФ-светом.
Реакции с реактивами группового осаждения алкалоидов. Хинин дает осадки с реактивами Бушарда, Драгендорфа, Майера, Зонненшейна и другими реактивами группового осаждения алкалоидов.
Обнаружение хинина по флуоресценции. Растворы хинина, подкисленные серной кислотой, имеют голубую флуоресценцию. При наличии ионов хлора и некоторых других ионов в растворах флуоресценция хинина ослабляется.
Флуоресценция хинина как двухосновного основания зависит от рН среды. В кислой среде хинин имеет голубую флуоресценцию. В щелочной среде (рН~9) хинин имеет фиолетовую флуоресценцию. Продукты окисления хинина имеют желто-зеленую флуоресценцию.
Выполнение опыта. Исследуемый раствор вносят в фарфоровую чашку и выпаривают досуха. К сухому остатку прибавляют 4—5 мл 0,1 н. раствора серной кислоты. Полученный раствор переносят в пробирку, которую облучают УФ-лучами. При наличии хинина появляется голубая флуоресценция раствора. От прибавления к этой жидкости нескольких капель 0,1 н. раствора гидроксида натрия интенсивность голубой флуоресценции ослабевает, а затем (при рН~9) появляется фиолетовая флуоресценция.
Если к раствору хинина, подкисленному серной кислотой, прибавить несколько капель бромной воды, разбавленной десятикратным объемом воды (до полного тушения флуоресценции), а затем прибавить несколько капель 25 %-го раствора аммиака до щелочной реакции, то появляется желто-зеленая флуоресценция.
Талейохинная реакция. От прибавления к хинину бромной воды, а затем аммиака образуется зеленого цвета талейохин, который экстрагируется хлороформом:
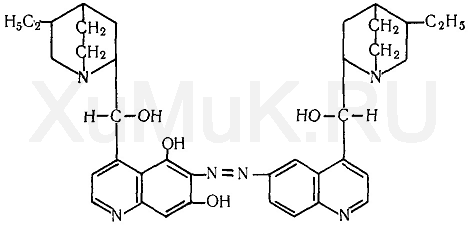
Выполнение реакции. Раствор исследуемого вещества выпаривают досуха. К сухому остатку прибавляют 1 мл воды. К полученному раствору по каплям прибавляют бромную воду (избегая ее избытка) до слабо-желтой окраски. От прибавления нескольких капель раствора аммиака к слабо-желтому раствору появляется ярко-зеленая окраска, которая при нейтральной реакции становится синей, а при добавлении кислоты переходит в красную или фиолетовую. При взбалтывании жидкости, имеющей зеленую окраску, с хлороформом последний приобретает зеленую окраску.
На воспроизводимость реакции влияет концентрация исследуемого вещества, объемы прибавляемых реактивов и т. д. Реакции мешают амидопирин, антипирин, кофеин и др.
Эритрохинная реакция. Несколько капель исследуемого раствора выпаривают досуха, прибавляют 1 мл воды, слабо подкисленной серной или уксусной кислотой, каплю бромной воды и каплю 10%-го раствора гексацианоферрата (III) калия. Полученную жидкость хорошо взбалтывают, затем по каплям прибавляют аммиак до щелочной реакции. При наличии хинина в исследуемом растворе появляется розовая или красно-фиолетовая окраска, которая при взбалтывании с хлороформом переходит в хлороформный слой.
Обнаружение хинина методом хроматографии. Для обнаружения хинина применяют метод хроматографии в тонком слое силикагеля. С этой целью используется та же методика, что и для обнаружения морфина (см. гл. V, § 34).
Пятна хинина на хроматограмме имеют розовато-бурую окраску (Rf = 0,39±0,01).
Обнаружение хинина по УФ- и ИК-спектрам. Основание хинина в этиловом спирте имеет максимумы поглощения при 236, 278 и 332 нм, а хинин в 0,1 н. растворе серной кислоты имеет максимумы поглощения при 250, 316 и 346 нм. В ИК-области спектра основание хинина (диск с бромидом калия) имеет основные пики при 1235, 1510, 1030 и 1619 см -1.
ОПИЙ И ОМНОПОН
Опий представляет собой сложную смесь алкалоидов, получаемую из снотворного мака. Для этой цели на недозревших коробочках (головках) снотворного мака делают надрезы, из которых вытекает млечный сок. Высохший на маковых коробочках млечный сок применяется в медицине под названием опий. В состав опия входит свыше 20 алкалоидов. В зависимости от сорта и места произрастания снотворного мака в опии может содержаться от 2—3 до 15—20 % алкалоидов, главными из которых являются морфин, кодеин, наркотин, тебаин и папаверин. Кроме алкалоидов в опии содержатся белковые вещества, углеводы, соли, кислоты и др. К веществам, которые сопутствуют алкалоидам в опии, относятся меконовая кислота и меконин (см. гл. V, § 25 и 26).
В медицине применяется порошок опия и галеновые препараты (экстракты, настойки, таблетки и др.), содержащие опий. Из алкалоидов, выделяемых из опия, в медицине применяются морфин, кодеин, папаверин и др.
Препараты опия применяются как болеутоляющие средства при болях различного происхождения, при некоторых желудочных заболеваниях и т. д. Опий и его препараты поступают в кровь из пищевого канала или при парентеральном введении. При курении опия входящие в его состав алкалоиды почти в несвязанном виде всасываются через легкие.
Обнаружение морфина, кодеина, наркотина и меконовой кислоты является доказательством наличия опия в исследуемых объектах. Ряд авторов считают, что для доказательства отравлений опием кроме обнаружения указанных выше веществ исследуемые объекты необходимо дополнительно проверить на наличие меконина. Это мотивируется тем, что реакции обнаружения меконовой кислоты малочувствительны и что она относительно быстро разлагается в биологическом материале. Для обнаружения меконовой кислоты необходимо, чтобы в исследуемом материале содержалось не меньше 0,05 г опия.
Обнаружение меконовой кислоты (см. гл. V, § 25) позволяет отличить опий от омнопона при исследовании вытяжек из биологического материала, поступившего на химико-токсикологический анализ. Опий содержит меконовую кислоту, а в омнопоне она отсутствует.
При химико-токсикологических исследованиях алкалоидов опия в биологическом материале их экстрагируют органическими растворителями из подщелоченных вытяжек. Морфин, кодеин, папаверин и тебаин хорошо экстрагируются органическими растворителями из щелочной среды. Однако значительное количество тебаина может экстрагироваться и из кислой среды. Наркотин начинает экстрагироваться хлороформом, 1,2-дихлорэтаном при рН выше единицы. При рН = 5...7 теми же органическими растворителями экстрагируется свыше 90 % наркотина (см. гл. V, § 24).
Омнопон (пантопон) представляет собой смесь гидрохлоридов алкалоидов опия. В состав омнопона входят около 50 % морфина и 32—35 % других алкалоидов. Омнопон представляет собой порошок от кремоватого до коричневато-желтого цвета. Он растворяется в воде (1 : 15) и этиловом спирте (1 :50). При взбалтывании водных растворов омнопона они сильно пенятся. Омнопон в основном применяется для тех же целей, что и морфин. Выпускается промышленностью в виде порошка и ампул. В 1 мл 1 %-го раствора омнопона содержится 6,7 морфина гидрохлорида, 2,7 наркотина, 0,72 кодеина, 0,36 папаверина гидрохлорида и 0,05 мг тебаина.
В химико-токсикологическом анализе при исследовании биологического материала на наличие омнопона в вытяжках определяют наличие морфина, кодеина и наркотина, а при исследовании биологического материала на наличие опия определяют те же алкалоиды и дополнительно проводят реакции идентификации на меконовую кислоту и по возможности на меконин (см. гл. V, § 26). В омнопоне меконовая кислота и меконин отсутствуют.
МОРФИН
Морфин является одним из главных алкалоидов опия, в котором содержится 3—20 % этого алкалоида. В молекуле морфина содержится атом азота, ОН-группа фенольного-и ОН-группа спиртового характера. Наличие атома азота и указанных ОН-групп обусловливает химические свойства морфина, используемые для аналитических целей. Осно вание морфина слабо растворяется в воде (в холодной 1 :5000, в кипящей — 1 :500) и диэтиловом эфире (1:7630). Еще хуже основание морфина растворяется в диэтиловом эфире, насыщенном водой (1 : 10 600). Основание морфина слабо растворяется в бензоле (1 : 1600) и хлороформе (1 : 1500), лучше — в этиловом спирте (в холодном 1 : 250, в кипящем — 1:13).
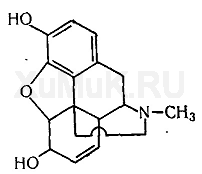
Ацетат морфина растворяется в этиловом спирте (1: 100), лучше — в воде (1 : 2,5), почти не растворяется в диэтиловом эфире.
Гидрохлорид морфина растворяется в этиловом спирте (1 : 100), воде (1 : 23), почти не растворяется в диэтиловом эфире и хлороформе.
Сульфат морфина слабо растворяется в этиловом спирте (1 : 1000), лучше — в воде (1 :21), практически не растворяется в диэтиловом эфире и хлороформе.
Тартрат морфина растворяется в воде (1 : 10), хуже — в этиловом спирте (1 : 1000), почти не растворяется в диэтиловом эфире и хлороформе.
Морфин экстрагируется органическими растворителями из щелочных водных растворов. Максимальные количества морфина экстрагируются хлороформом при рН = 8,6...10,2.
Применение. Действие на организм. В медицине применяется гидрохлорид морфина. Этот препарат является основным представителем группы наркотических анальгетиков.
Морфин оказывает сильное болеутоляющее действие, понижает возбудимость болевых центров, оказывает противошоковое действие при травмах и т. д. Морфин вызывает эйфорию. При повторном применении морфина к нему быстро развивается болезненное пристрастие (морфинизм). Слабо всасывается в кровь через пищеварительную систему. После парентерального введения морфина в организм максимальный уровень его в крови достигается примерно через 1 ч.
Метаболизм. В организме основное количество морфина связывается с глюкуроновой кислотой и в виде глюкуронида выделяется с мочой. За первые 8 ч после введения морфина 50 % его выделяется с мочой в виде глюкуронида, а за 24 ч выделяется из организма примерно 90 % глюкуронида морфина. В организме незначительная часть морфина подвергается N-деметилированию (образуется норморфин) и О-метилированию (образуется кодеин).
В органах трупов морфин постепенно превращается в псевдоморфин (оксидиморфин, дегидроморфин), по которому определяют отравление морфином.
Выделение морфина из биологического материала. Для выделения морфина из биологического материала рекомендованы методы, основанные на изолировании этого алкалоида спиртом, подкисленным щавелевой кислотой, или водой, подкисленной щавелевой или серной кислотой. Большие количества морфина выделяются с помощью метода, основанного на изолировании его водой, подкисленной серной кислотой.
Дата добавления: 2016-06-29; просмотров: 2713;











