Механизм ферментативного катализа
Последовательность событий в ферментативном катализе можно описать следующей схемой. Вначале формируется субстрат-ферментный комплекс. При этом происходит изменение конформаций ферментной молекулы и молекулы субстрата, последняя фиксируется в активном центре в напряженной конфигурации. Так формируется активированный комплекс, или переходное состояние, — высокоэнергетическая промежуточная структура, которая энергетически менее устойчива, чем исходные соединения и продукты. Важнейший вклад в суммарный каталитический эффект вносит процесс стабилизации переходного состояния —взаимодействия между аминокислотными остатками белка и субстратом, находящимся в напряженной конфигурации. Разность значений свободной энергии для исходных реагентов и переходного состояния соответствует свободной энергии активации (ΔG#). Скорость реакции зависит от величины (ΔG#) : чем она меньше, тем больше скорость реакции, и наоборот. По сути DG представляет собой «энергетический барьер», который требуется преодолеть для осуществления реакции. Стабилизация переходного состояния понижает этот «барьер» или энергию активации. На следующем этапе происходит сама химическая реакция, после чего образовавшиеся продукты освобождаются из фермент-продуктного комплекса.
Можно выделить несколько причин высокой каталитической активности ферментов, которые обеспечивают снижение энергетического барьера реакции.
1. Фермент может связывать молекулы реагирующих субстратов таким образом, что их реакционноспособные группы будут располагаться поблизости друг от друга и от каталитических групп фермента (эффект сближения).
2. При образовании субстрат-ферментного комплекса достигаются фиксация субстрата и его оптимальная для разрыва и образования химических связей ориентация (эффект ориентации).
3. Связывание субстрата приводит к удалению его гидратной оболочки (существует на растворенных в воде веществах).
4. Эффект индуцированного соответствия субстрата и фермента.
5. Стабилизация переходного состояния.
6. Определенные группы в молекуле фермента могут обеспечивать кислотно-основный катализ(перенос протонов в субстрате) и нуклеофильный катализ (формирование ковалентных связей с субстратом, что приводит к образованию более реакционноспособных структур, чем субстрат).
Одним из примеров кислотно-основного катализа является гидролиз гликозидных связей в молекуле муреина с помощью лизоцима. Лизоцим представляет собой фермент, присутствующий в клетках различных животных и растений: в слезной жидкости, слюне, курином белке, молоке. Лизоцим из куриных яиц имеет молекулярную массу 14 600 Да, состоит из одной полипептидной цепи (129 аминокислотных остатков) и имеет 4 дисульфидных мостика, что обеспечивает высокую стабильность фермента. Рентгеноструктурный анализ молекулы лизоцима показал, что она состоит из двух доменов, образующих «щель», в которой находится активный центр. Вдоль этой «щели» связывается гексосахарид, причем для связывания каждого из шести сахарных колец муреина на ферменте имеется свой участок (А, В, С, D, E и F) (рис. 6.4).
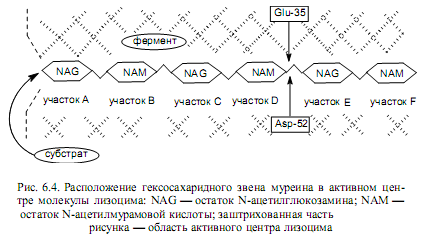
Молекула муреина удерживается в активном центре лизоцима в основном благодаря водородным связям и гидрофобным взаимодействиям. В непосредственной близости к месту гидролиза гликозидной связи расположены 2 аминокислотных остатка активного центра: глутаминовая кислота, занимающая 35-е положение в полипептиде, и аспарагиновая кислота — 52-е положение в полипептиде (рис. 6.5).
Боковые цепи этих остатков располагаются на противоположных поверхностях «щели» в непосредственной близости к атакуемой гликозидной связи — примерно на расстоянии 0,3 нм. Остаток глутамата находится в неполярном окружении и не ионизирован, а остаток аспартата— в полярном окружении, его карбоксильная группа депротонирована и участвует в качестве акцептора водорода в сложной сети водородных связей.
Процесс гидролиза осуществляется следующим образом. Протонирован карбоксильная группа остатка Glu-35 предоставляет свой протон гликозидному атому кислорода, что приводит к разрыву связи между этим атомом кислорода и С1-атомом сахарного кольца, располагающегося в участке D (стадия общего кислотного катализа). В результате образуется продукт, включающий в себя сахарные кольца, находившиеся в участках E и F, который может высвободиться из комплекса с ферментом. Конформация сахарного кольца, расположенного в участке D, искажается, принимая конформацию полукресла, в которой пять из шести атомов, образующих сахарное кольцо, лежат практически в одной плоскости. Эта структура соответствует конформации переходного состояния. При этом С1-атом оказывается положительно заряженным и промежуточный продукт носит название карбоний-иона (карбкатиона). Свободная энергия переходного состояния уменьшается за счет стабилизации карбоний-иона депротонированной карбоксильной группой остатка Asp-52 (рис. 6.5).
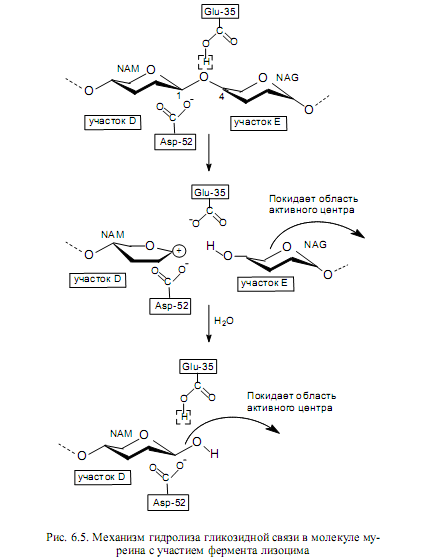
На следующем этапе в реакцию вступает молекула воды, которая замещает диффундирующий из области активного центра дисахаридный остаток. Протон молекулы воды переходит к Glu-35, а гидроксильный ион (ОН- ) к атому С1 карбоний-иона (стадия общего основного катализа). В результате второй фрагмент расщепленного полисахарида становится продуктом реакции (конформация кресла) и уходит из области активного центра, а фермент возвращается в исходное состояние и готов осуществить следующую реакцию расщепления дисахарида (рис.6.5).
Свойства ферментов
Характеризуя свойства ферментов, в первую очередь оперируют понятием «активность». Под активностью фермента понимают такое его количество, которое катализирует превращение определенного количества субстрата в единицу времени. Для выражения активности препаратов ферментов используют две альтернативные единицы: международную (Е) и «катал» (кат). За международную единицу активности фермента принято то его количество, которое катализирует превращение 1 мкмоль субстрата в продукт за 1 мин в стандартных условиях (обычно оптимальных). Один катал обозначает количество фермента, катализирующее превращение 1 моль субстрата за 1 с. 1 кат=6*107 Е.
Часто ферментные препараты характеризуются удельной активностью, которая отражает степень очистки фермента. Удельная активность — это число единиц активности фермента на 1 мг белка.
Активность ферментов в очень сильной степени зависит от внешних условий, среди которых первостепенное значение имеют температура и рН среды. Повышение температуры в интервале 0—50° С обычно приводит к плавному увеличению ферментативной активности, что связано с ускорением процессов формирования субстрат-ферментного комплекса и всех последующих событий катализа. Однако дальнейшее повышение температуры, как правило, сопровождается увеличением количества инактивированного фермента за счет денатурации его белковой части, что выражается в снижении активности. Каждый фермент характеризуется температурным оптимумом — значением температуры, при котором регистрируется наибольшая его активность. Чаще для ферментов растительного происхождения температурный оптимум лежит в пределах 50—60° С, а животного — между 40 и 50° С. Ферменты термофильных бактерий характеризуются очень высоким температурным оптимумом.
Зависимость активности ферментов от значений рН среды также имеет сложный характер. Для каждого фермента характерен оптимум рН среды, при котором он проявляет максимальную активность. При удалении от этого оптимума в одну либо другую сторону ферментативная активность снижается. Это объясняется изменением состояния активного центра фермента (уменьшением или увеличением ионизации функциональных групп), а также третичной структуры всей белковой молекулы, которая зависит от соотношения в ней катионных и анионных центров. Большинство ферментов имеют оптимум рН в области нейтральных значений. Однако есть ферменты, проявляющие максимальную активность при рН 1,5 (пепсин) или 9,5 (аргиназа).
Активность ферментов подвержена значительным колебаниям в зависимости от воздействия ингибиторов(вещества, снижающие активность) и активаторов (вещества, увеличивающие активность). Роль ингибиторов и активаторов могут выполнять катионы металлов, некоторые анионы, переносчики фосфатных групп, восстановительных эквивалентов, специфические белки, промежуточные и конечные продукты метаболизма и др. Эти вещества могут попадать в клетку извне либо вырабатываться в ней. В последнем случае говорят о регуляции активности ферментов — неотъемлемом звене в общей регуляции метаболизма.
Воздействующие на активность ферментов вещества могут связываться с активным и аллостерическим центрами фермента, а также вне этих центров. Частные примеры подобных явлений будут рассмотрены в главах 7— 19. Для обобщения некоторых закономерностей ингибирования активности ферментов следует указать, что эти явления в большинстве случаев сводятся к двум типам — обратимому и необратимому. В ходе обратимого ингибирования в молекулу фермента не вносится каких-либо изменений после его диссоциации с ингибитором. Примером служит действие аналогов субстрата, которые могут связываться с активным центром фермента, препятствуя взаимодействию фермента с истинным субстратом. Однако увеличение концентрации субстрата приводит к «вытеснению» ингибитора из активного центра, и скорость катализируемой реакции восстанавливается (конкурентное ингибирование). Другой случай обратимого ингибирования представляет собой связывание ингибитора с простетической группой фермента, или апоферментом, вне активного центра. Например, взаимодействие ферментов с ионами тяжелых металлов, которые присоединяются к сульфгидрильным группам остатков аминокислот фермента, белок-белковые взаимодействия или ковалентая модификация фермента. Такое ингибирование активности называется неконкурентным.
Необратимое ингибирование в большинстве случаев основано на связывании так называемых «суицидных субстратов» с активными центрами ферментов. При этом между субстратом и ферментом формируются ковалентные связи, которые расщепляются очень медленно и фермент долго не способен выполнять свою функцию. Примером «суицидного субстрата» служит антибиотик пенициллин (глава 18, рис. 18.1).
Поскольку для ферментов характерна специфичность действия, их классифицируют по типу реакции, подвергающейся катализу. Согласно принятой в настоящее время классификации, ферменты группируют в 6 классов:
1. Оксидоредуктазы (окислительно-восстановительные реакции).
2. Трансферазы (реакции переноса функциональных групп между субстратами).
3. Гидролазы (реакции гидролиза, акцептором переносимой группы является молекула воды).
4. Лиазы (реакции отщепления групп негидролитическим путем).
5. Изомеразы (реакции изомеризации).
6. Лигазы, или синтетазы (реакции синтеза за счет энергии расщепления нуклеозидтрифосфатов, чаще АТР).
Номер соответствующего класса фермента закреплен в его кодовой нумерации (шифре). Шифр фермента состоит из четырех разделенных точками чисел, обозначающих класс фермента, подкласс, подподкласс и порядковый номер в подподклассе.
Дата добавления: 2016-05-30; просмотров: 4582;











