Отличие обычного и бестопливного горения
Обычное горение
1. При обычном горении, например, углерода 12С, углеродные цепочки топлива разрушаются на отдельные элементы так, что на каждый атом углерода приходится по одному электрону их связи, который становится свободным
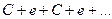 (1)
(1)
2. Молекулы кислорода воздуха, каждая из которых состоит из двух атомов и электрона их связи, разрушаются на положительно заряженный атом (ион) и отрицательно заряженный ион, состоящий из положительно заряженного атома кислорода и соединенного с ним электрона связи
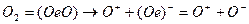 (2)
(2)
3. Свободный электрон, полученный в плазме горения от топлива (1), становится электроном – генератором энергии в соответствии с физическим механизмом ФПВР: электродинамически взаимодействует с ионами О+, послойно, отбирая у них мелкие элементарные частицы, что создает малый дефект массы атома кислорода (порядка 10-6%). Такой ничтожный дефект массы позволяет сохранить химические свойства кислорода. По окончании процесса энерговыделения (ФПВР) продукты реакции объединяются в наиболее устойчивое соединение (СО2)
С + О2 = СО2 или с учетом электронов
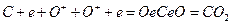 (3)
(3)
4. Как видно, при обычном горении идет атомная реакция расщепления кислорода. За счет энергии связи его элементарных частиц и выделяется тепловая энергия.
Топливо является донором электронов.
Реакция окисления (3) является следствием горения.
Азот в обычном горении участия не принимает, являясь балластом в составе воздуха.
Необычное – «бестопливное» горение
5. Если разрушить молекулу кислорода с выделением свободного электрона связи
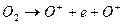 , (4)
, (4)
то этот свободный электрон станет электроном-гене-ратором энергии точно так же, как электрон, полученный от топлива (1).
6. Тогда исключается необходимость в топливе и горение становится бестопливным, но с тем же дефицитом массы кислорода Dm как при обычном горении
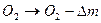 . (5)
. (5)
7. В чистом кислороде реакция энерговыделения по (4) идет со взрывом (быстрое горение). Для ее начала достаточно, как известно, следов углеводородов (смазочное масло, бензин, дизтопливо и т.п.).
В воздухе взрыву препятствует азот. Молекулы азота, имея отрицательный избыточный заряд окружают каждую молекулу кислорода, имеющую положительный избыточный заряд, образуя агрегаты из кислорода, экранированного азотом от действия электронов.
8. То есть для бестопливного горения необходимо не только разбить кислород по (4), но и предварительно разбить агрегаты кислорода с азотным экраном. Таким образом, азот не просто балласт, а структурно организованная среда препятствующая доступу к кислороду и его взрыву.
9. Если инициирующее воздействие достаточно для разрушения азота, молекула которого в два раза прочнее молекулы кислорода, так как имеет не один, а два электрона связи, то азот при этом разрушается не только на атомы, но и фрагменты, представляющие другие химические элементы
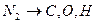 . (6)
. (6)
10. Эти элементы, особенно, кислород и водород, вступают в реакцию энерговыделения (ФПВР) с электронами – генераторами энергии.
11. Участие азота в ФПВР увеличивает мощность реакции энерговыделения за счет дополнительной энергии связи элементарных частиц в атомах, указанных веществ. Такая реакция горения называется азотной реакцией.
12. Продуктами азотной реакции являются, в основном, водяной пар (вода) Н2О, частично кислород О2, углерод С и в меньшей степени СО2, СО, NOХ и другие вещества.
Дата добавления: 2016-06-29; просмотров: 1635;











