Регуляция генной экспрессии на уровне транскрипции
Каждая клетка целого организма или популяции содержит полный набор генов, свойственный для данного вида (штамма). Однако в любой момент времени в клетке функционируют (экспрессируются) не все гены, а лишь те, в продуктах которых имеется потребность. Такое распределение «обязанностей» между генами возможно благодаря существованию механизмов регуляции генной экспрессии, которые функционируют на разных уровнях. С помощью этих механизмов клетка экономит свои ресурсы: в каждый конкретный момент она синтезирует определенный ограниченный набор веществ, а не весь возможный их спектр и, кроме того, осуществляет координацию метаболических путей.
Среди нескольких уровней регуляции экспрессии генов наиболее существенной и часто используемой является регуляция синтеза ферментов, которая осуществляется на уровне транскрипции. Суть такого типа регуляции сводится к ускорению или замедлению процессов транскрипции определенных генов, что в конечном итоге отражается на скорости синтеза их продуктов. Различают позитивную и негативную регуляцию транскрипции. Негативная регуляция предусматривает торможение инициации транскрипции за счет связывания с операторной областью белков-репрессоров; позитивная регуляция — наоборот, охватывает события «включения» транскрипции, которые также обусловливаются присоединением к оператору специфических белков (в данном случае их называют активаторами).
Наилучшим образом регуляция синтеза ферментов изучена у прокариот. Их особенностью является организация генов, участвующих в одном метаболическом пути, в опероны. Это дает возможность прокариотам «включать» и «выключать» транскрипцию группы генов (входящих в оперон) одновременно. Несколько разных типов регуляции инициации транскрипции (оперонной регуляции) будет рассмотрено в данной теме на примерах двух оперонов E. coli — лактозном, принадлежащем к группе катаболитных оперонов, и триптофановом—анаболическом.
Регуляция инициации транскрипции у эукариот осуществляется гораздо сложнее, чем у прокариот, но основные ее закономерности соблюдаются и в этом случае.
Регуляция экспрессии лактозного оперона по типу индукции. Лактозный оперон E.coli содержит регуляторную область (промотор и оператор) и три структурных гена: lacZ (кодирует структуру b-галактозидазы), lacY (определяет структуру b-галактозидпермеазы) и lacA (структура b-галактозидтрансацетилазы) (рис. 3.5). Названные ферменты обусловливают перенос в клетку дисахарида лактозы и расщепление ее на глюкозу и галактозу. Транскрипция структурных генов лактозного оперона осуществляется согласованно: гены lacZ, lacY и lacA транскрибируются в одну полицистронную мРНК, которая транслируется с образованием почти одинаковых количеств каждого из ферментных белков. Недалеко от лактозного оперона на хромосоме E. coli располагается ген I, кодирующий структуру белка-репрессора. Этот белок в свободном состоянии имеет сродство к операторной области lac-оперона.
Когда клетки кишечной палочки выращиваются на среде с глюкозой в качестве единственного источника углерода, они содержат очень мало белков — продуктов структурных генов лактозного оперона: примерно по 10 молекул на клетку. В присутствии лактозы и других b-галактозидов концентрация этих белков возрастает до 10 000 и более молекул на клетку. В этом случае лактоза (b-галактозиды) служит индуктором синтеза названных ферментов, и это означает, что соответствующий оперон регулируется по типу индукции, т. е. кодируемые им ферменты синтезируются только в присутствии индуктора.
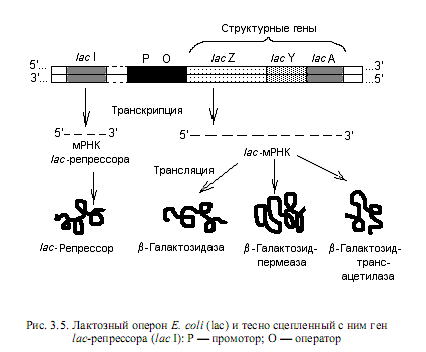
Механизм индукции состоит в следующем. В отсутствие индуктора свободный белок-репрессор (тетрамерная молекула) прочно связывается с операторной областью lac-оперона (рис. 3.6). Поскольку промоторная и операторная последовательности перекрываются, связывание репрессора с оператором становится помехой для присоединения РНК-полимеразы к промотору, что приводит к блокированию транскрипции структурных генов. Однако присутствие в клетке лактозы или иного индуктора lac-оперона приводит к образованию комплекса индуктора с репрессором, который утрачивает сродство к оператору и освобождает регуляторную область (рис. 3.6). Осуществляется транскрипция структурных генов, и на сформированной мРНК синтезируются соответствующие белки.
Таким образом, существование явления индукции позволяет клетке экономить свои ресурсы, поскольку обеспечивает транскрипцию индуцибельных генов и синтез соответствующих ферментов не постоянно, а только при наличии индуктора в среде.
У бактерий E. coli получены мутации, которые выражаются в уменьшении или исчезновении сродства репрессора к оператору. У таких мутантов наблюдается конститутивный синтез ферментов лактозного оперона, т. е. его экспрессия наблюдается и в отсутствие индуктора.
Регуляция синтеза ферментов по типу индукции относится к негативному
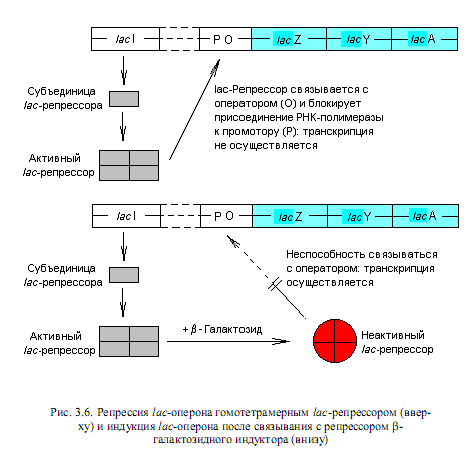
контролю. Кроме этого, работа лактозного оперона и многих других оперонов подвержена позитивной регуляции, которую можно рассмотреть на примере катаболитной репрессии.
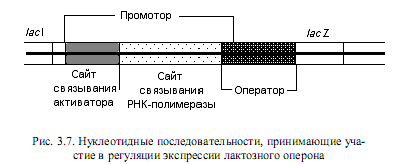
Регуляция работы лактозного оперона по типу катаболитной репрессии. Позитивная регуляция транскрипции лактозного оперона заключается в связывании активаторного комплекса со специфической последовательностью, расположенной в самом начале lac-промотора. Это приводит к стимулированию процесса транскрипции lac-оперона, в результате чего скорость синтеза соответствующей мРНК увеличивается почти в 50 раз. Данный феномен не имеет пока окончательного объяснения, однако существует несколько гипотез, описывающих процесс стимулирования транскрипции. Согласно наиболее общепринятой из них, активаторный комплекс связывается с той частью промотора, которая непосредственно прилегает к сайту присоединения РНК-полимеразы (рис. 3.7) и усиливает сродство этого фермента к промотору. Альтернативная гипотеза заключается в том, что связывание активаторного комплекса с промотором предотвращает присоединение РНК-полимеразы к расположенному поблизости слабому промотору и увеличивает тем самым вероятность связывания фермента с «правильным» промоторным сайтом.
Функцию активатора транскрипции в данном случае выполняет комплекс циклического АМР (сАМР) с белком-активатором катаболизма (САР, от англ. catabolite activator protein ). Этот комплекс выполняет аналогичные функции и при регуляции экспрессии многих других катаболитных оперонов. Свободный белок САР не способен связываться со специфической последовательностью в составе промотора и требует участия сАМР.
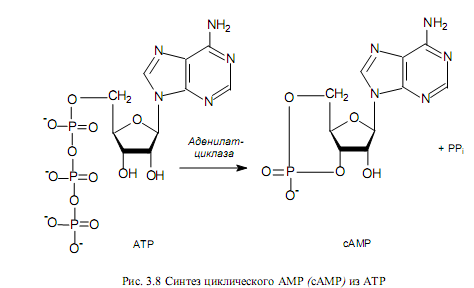
сАМР образуется из АТР (рис. 3.8) в ходе ферментативного превращения в ответ на различные клеточные события и сигналы. Это вещество-посредник принимает участие во многих процессах, и с его помощью осуществляется регуляция различных граней клеточного метаболизма. Содержание сАМР в клетке контролируется с помощью двух уравновешивающих друг друга процессов: синтеза при участии аденилатциклазы (рис. 3.8) и деградации под действием фосфодиэстеразы. Глюкоза ускоряет распад сАМР и ингибирует процесс его синтеза, т. е. в присутствии глюкозы наблюдается низкий, а в отсутствие — высокий уровень сАМР в клетке.
Таким образом, содержание сАМР и, соответственно, активаторного комплекса сАМР-САР зависит от наличия в клетке глюкозы. У бактерий, растущих на глюкозе, концентрация этих веществ очень низкая, поэтому даже в присутствии индукторов транскрипция лактозного и подобных ему оперонов не осуществляется, и в клетке не синтезируются ферменты, принимающие участие в катаболизме соответствующих сахаров (лактозы, арабинозы, галактозы и др.). Это явление и обозначают термином «катаболитная репрессия».
Регуляция работы триптофанового оперона по типу репрессии. Триптофановый оперон E. coli содержит в своем составе пять структурных генов (trpE, trpD, trpC, trpB, trpA), определяющих аминокислотные
последовательности пяти ферментов, участвующих в превращении хоризмата в триптофан. Кроме этого, в состав оперона входит лидерный сегмент trpL и регуляторная область (перекрывающиеся последовательности промотора и оператора), принимающие участие в регуляции транскрипции структурных генов (рис. 3.9). В ином сайте нуклеоида кишечной палочки (на достаточном удалении от trp-оперона) расположен ген trpR, кодирующий структуру белка-репрессора.
Структурные гены trp-оперона транскрибируются в виде полицистронной мРНК длиной 7000 нуклеотидов. Синтез мРНК инициируется на промоторе, последовательность которого перекрывается с оператором (рис. 3.9). Транскрипция контролируется взаимодействием с оператором белка-репрессора, эффектором которого служит конечный продукт данного биосинтетического пути — триптофан. Когда в клетке присутствует свободный триптофан, он связывается с репрессором и оказывает аллостерическое воздействие на структуру последнего, в результате чего репрессор приобретает способность прочно связываться с оператором. В этом случае триптофан выполняет роль корепрессоратриптофанового оперона.
Связывание комплекса триптофан—репрессор с операторной областью препятствует правильному взаимодействию РНК-полимеразы с промотором, поскольку последовательности оператора и промотора перекрываются. Транскрипция trp-оперона блокируется, и ферменты, участвующие в синтезе триптофана, не образуются.
В отсутствие триптофана не происходит связывания свободного белка-репрессора с оператором, и транскрипция оперона не нарушается. В данном случае происходит интенсивный синтез пяти ферментов, превращающих хоризмат в триптофан. Благодаря процессам регуляции содержание этих ферментов в клетке E. coli может различаться до 700 раз в зависимости от внутриклеточного уровня триптофана.
С помощью репрессии регулируется работа и других оперонов, в частности тех, которые участвуют в биосинтезе других аминокислот. Для некоторых из этих оперонов характерен еще один способ регуляции —аттенуация.
Аттенуация экспрессии триптофанового оперона . Этот способ регуляции экспрессии trp-оперона связывает между собой два процесса: транскрипцию и трансляцию. В нем задействован регуляторный сегмент ДНК, расположенный перед структурным геном trpЕ. Этот так называемый лидерный сегмент trpL содержит аттенуаторную последовательность длиной ~145 пар нуклеотидов. При наличии свободного триптофана в клетке осуществляется транскрипция аттенуаторной последовательности, после чего происходит ее преждевременная терминация и отделяется trp-лидерная мРНК (145 нуклеотидов). При отсутствии триптофана преждевременной терминации не происходит и транскрибируется полноразмерная триптофановая мРНК. Таким образом, в составе аттенуаторной последовательности содержится сигнал, регулирующий транскрипцию структурных генов.

Секвенс-анализ аттенуаторной последовательности позволил обнаружить в ее составе три необычных сегмента: один из них кодирует структуру короткого полипептида, в состав которого входит 14 аминокислот, в том числе два расположенных рядом остатка триптофана; два других сегмента содержат инвертированные повторы, способные образовывать шпильки разной структуры при спаривании комплементарных нуклеотидов. Одна из двух шпилечных структур не препятствует процессу транскрипции, а вторая опосредует r-независимую преждевременную терминацию транскрипции. Какая именно из двух шпилечных структур будет реализована, зависит от концентрации триптофана в клетке: при его отсутствии (или невысоком содержании) не может полностью синтезироваться короткий пептид, содержащий два тандемных повтора данной аминокислоты, и это служит сигналом для формирования шпильки, не препятствующей транскрипции. При содержании триптофана в клетке на уровне от среднего до высокого происходит синтез короткого пептида, кодируемого аттенуаторной последовательностью, и в этом случае рибосомы доходят до терминирующего кодона в лидерной мРНК, что обусловливает формирование шпилечной структуры, прерывающей дальнейший процесс транскрипции. Таким образом, аттенуация преждевременной терминации транскрипции происходит при низком содержании или почти полном отсутствии триптофана в клетке, и сигналом для этого служит особое положение рибосомы на лидерной мРНК.
Экспрессия триптофанового, а также некоторых других анаболических оперонов (гистидинового, треонинового, изолейцинвалинового) достигает максимума в отсутствие репрессии и при максимальной аттенуации терминации транскрипции.
Дата добавления: 2016-05-30; просмотров: 5293;











