Явление рестрикции—модификации ДНК
В систему рестрикции—модификации входят ферменты, относящиеся к двум классам: одни из них модифицируют молекулы ДНК, находящиеся в клетке, а другие расщепляют чужеродные молекулы ДНК (или свои, не модифицированные) в этих же сайтах.
Впервые явление рестрикции—модификации обнаружено С. Лурия в 50-х гг. прошлого столетия в экспериментах по инфицированию бактерий E coli бактериофагом l. Оказалось, что бактериофаги, размноженные на бактериях одного штамма кишечной палочки, инфицировали клетки некоторых других штаммов с низкой эффективностью. Наблюдалось и обратное явление: полученные в ходе этого низкопродуктивного литического цикла фаги инфицировали клетки исходного штамма также плохо. Было высказано предположение, которое впоследствии подтвердилось, что фаговая ДНК подвергается в бактериях E. coli модификации, которая защищает ее от хозяйских ферментов рестрикции, но не от подобных ферментов в других штаммах.
В настоящее время известно, что модификацией, защищающей геном клетки и некоторые инфицирующие фаговые ДНК, является штамм-специфичное метилирование определенных азотистых оснований в ДНК. Причем ферментативное присоединение заместителей к азотистым основаниям происходит уже после включения соответствующих нуклеотидов в цепи ДНК, начиная с этапа образования фрагментов Оказаки. Метилируются нуклеотиды, занимающие строго определенное положение в молекуле, а ферменты, осуществляющие эти реакции, относятся к единой системе рестрикции—модификации. Ферменты рестрикции, входящие в такую систему, узнают в ДНК те же последовательности нуклеотидов и осуществляют специфическое расщепление ДНК в этих (либо прилегающих) последовательностях, если они не модифицированы.
Структура сайтов рестрикции—модификации расшифрована для более чем 200 рестрикционных ферментов.
Различают три типа эндонуклеаз рестрикции (I, II, III). Ферменты I и III типов обладают как нуклеазной, так и метилирующей активностями. При этом эндонуклеазы I типа узнают в ДНК определенную последовательность и разрезают двухцепочечную ДНК на разном (не фиксированном) расстоянии от сайтов узнавания. Эндонуклеазы типа III осуществляют двухцепочечные разрезы ДНК на расстоянии ~25 п. н. от своих сайтов узнавания. Только эндонуклеазы типа II производят двухцепочечные разрезы ДНК по специфическим фосфодиэфирным связям либо в пределах самого сайта узнавания, либо на небольшом, но вполне определенном удалении от него. Ферменты этого типа не обладают метилирующей активностью. Некоторые из эндонуклеаз II типа узнают специфические группы из четырех нуклеотидов, другие — гексануклеотидные последовательности, причем их общей особенностью является палиндромная структура (рис. 2.1). В этом случае одна и та же последовательность располагается в двух цепях в противоположных направлениях симметрично, относительно оси симметрии в середине палиндрома.

Как показано на рис. 2.1, результатом действия многих рестриктаз на молекулы ДНК, является разрезание их «уступом» в немодифицированных сайтах. При таком способе расщепления двухцепочечных ДНК образуются фрагменты, у которых имеется концевая избыточность, или так называемые «липкие» концы. В составе «липких» концов, образованных под действием дной рестриктазы, последовательности нуклеотидов комплементарны (рис. 2.1). Указанные особенности функционирования рестриктаз II типа делают их незаменимыми инструментами в генетической инженерии: это молекулярные ножницы, с помощью которых in vitro осуществляется фрагментирование ДНК.
В настоящее время рестрикционные ферменты выделены из более чем 400 штаммов бактерий, и для большей их части определена структура сайтов рестрикции. Система рестрикции—модификации может рассматриваться как своеобразный барьер, охраняющий клетку от включения в нее чужеродного генетического материала. Возникновение мутантов, лишенных способности к рестрикции, открывает дополнительные возможности для изменчивости у этих штаммов.
Недавно обнаружена способность некоторых конъюгативных плазмид и фагов преодолевать барьеры рестрикции клеток-хозяев, куда они попадают при конъюгации или инфекционном процессе. Это явление получило название антирестрикция. В геномах плазмид и фагов обнаружены гены ard, детерминирующие структуру белков-антирестриктаз. Эти белки ингибируют ферменты, принадлежащие к системе рестрикции—модификации типа I.
Репарация ДНК
Несмотря на высокую точность работы ферментов, осуществляющих репликацию ДНК, а также на существование механизма корректорской правки, при синтезе новых цепей ДНК все же происходят ошибки, связанные с включением в их состав некомплементарных нуклеотидов. Кроме того, молекулы ДНК подвергаются в клетках воздействию разнообразных физических и химических факторов, нарушающих их структуру. К числу наиболее часто возникающих повреждений ДНК можно отнести следующие:
— разрыв (b-N)-гликозидных связей между пурином и дезоксирибозой (депуринизация), который чаще всего является следствием повышения температуры. За сутки в клетке человека совершается от 5000 до 10 000 актов депуринизации;
— спонтанное дезаминирование остатков цитозина и аденина с образованием, соответственно, остатков урацила и гипоксантин (примерно 100 событий на геном в сутки);
— алкилирование азотистых оснований под действием химических веществ особого класса (алкилирующих агентов);
— интеркаляция (встраивание) некоторых соединений между соседними парами нуклеотидов;
— образование ковалентных сшивок между цепями ДНК под действием бифункциональных агентов;
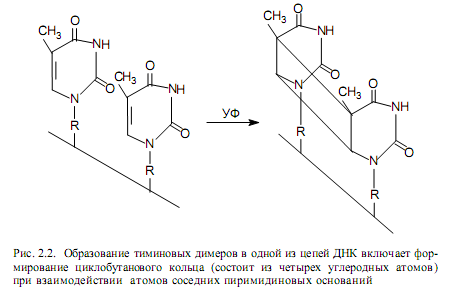
— образование, возникающих при поглощении ультрафиолетового света (УФ) циклобутановых димеров (рис. 2.2) между соседними пиримидинами в цепи.
Большинство перечисленных повреждений нарушает процессы репликации и экспрессии генов, например, каждый тиминовый димер в ДНК E. coli задерживает репликацию на 10 с. Кроме того, эти повреждения являются источником мутаций, если их исправление не осуществится до начала репликации ДНК.
Чаще всего подобные нарушения происходят лишь в одной из нитей ДНК, при этом во второй нити напротив повреждения в большинстве случаев содержится «правильная» последовательность, которая может служить матрицей для исправления ошибок. Таким образом, двойная спираль ДНК, а также то, что в ней закодирована информация о структуре репарационных ферментов, делает возможным уникальный механизм исправления ошибок — репарацию, характерный только для одного класса молекул — ДНК.
Репарационных систем и механизмов, существующих у разных организмов, очень много, среди них есть такие, которые специфичны лишь для исправления повреждений одного рода, а есть и менее специфичные. Для удобcтва все известные к настоящему времени репарационные процессы можно разделить на две категории: 1) те, что не требуют участия репликации и представляют собой непосредственное исправление нарушений в ДНК; 2) более сложные процессы, в ходе которых происходит репарационная репликация. Лучше всего репарационные механизмы изучены по отношению к исправлению повреждений, вызванных УФ-облучением, — пиримидиновых димеров (рис. 2.2).
Поскольку в наиболее известных процессах репарации последствий УФ-облучения принимают участие зависимые от УФ-света ферменты, репарационные механизмы делят также на световую (способную осуществиться лишь на видимом свету) и темновую (не требующую участия видимого света) репарацию.
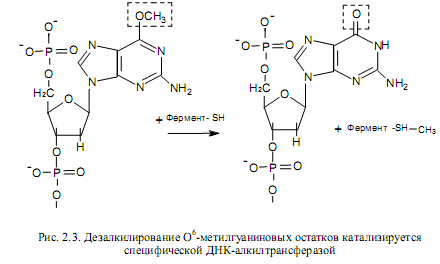
К репарационным механизмам прямого исправления повреждений можно отнести дезалкилирование остатков гуанина и мономеризацию циклобутановых димеров между соседними пиримидиновыми основаниями. Дезалкилирование метилгуаниновых остатков относится к темновой репарации и происходит при участии ферментов, присутствующих в клетках бактерий и питающих. О6 -метилгуанин-ДНК-алкил-трансфераза катализирует перенос алкильных групп на сульфгидрильные группы цистеиновых остатков фермента (рис. 2.3).
Расщепление димеров между пиримидиновыми нуклеотидами происходит в процессе фотореактивации— восстановления структуры молекул ДНК, поврежденных УФ-излучением в результате последующего воздействия видимого света (световая репарация). Известна неферментативная коротковолновая фотореактивация, которая заключается в мономеризации димеров при действии ультрафиолетового излучения с длиной волны 240 нм, а также ферментативная фотореактивация. Последнюю обычно и подразумевают под собственно фотореактивацией. Этот процесс требует участия видимого света с длиной волны 300—600 нм и осуществляется под действием специфических фотореактивирующих ферментов (дезоксирибопиримидинфотолиазы). Субстратом фотолиазы служат димеры пиримидиновых оснований, с которыми она образует комплекс (с неповрежденной ДНК фермент не связывается). Используя энергию поглощенного света, фермент разрушает димер без разрыва цепей ДНК (рис. 2.4).

Явление фотореактивации широко распространено в природе и обнаружено даже у таких примитивных микроорганизмов, как микоплазмы. Фотореактивирующие ферменты найдены у некоторых высших растений и животных, а также у всех изученных бактерий, за исключением Deinococcus radiodurans, который, тем не менее, чрезвычайно устойчив к действию УФ-света: эти бактерии выдерживают дозы в 1000 раз более высокие, чем те, которые убивают E. coli. При полном отсутствии способности к фотореактивации D. radiodurans обладает мощной системой эксцизионной репарации.
Репарационные события, связанные с заменой искаженных участков, не требуют участия видимого света и в них, кроме других ферментов, важную роль играют нуклеазы двух типов: экзо- и эндонуклеазы. Экзонуклеазы осуществляют расщепление ДНК, начиная с концов цепей, а эндонуклеазы атакуют цепи во внутренних частях, формируя в ДНК однонитевые разрывы. Среди многообразия разных видов репарации, связанной с репаративным cинтезом ДНК, можно выделить два основных: эксцизионную и пострепликативную репарацию.
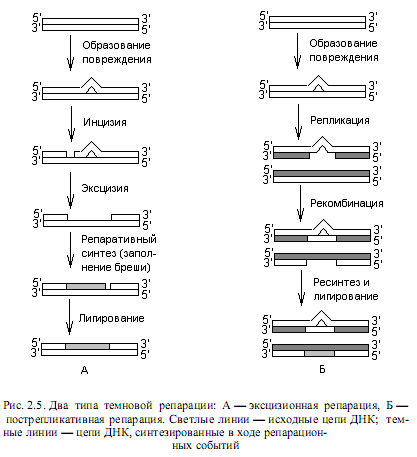
Эксцизионная репарация. Отличительной особенностью эксцизионной репарации является удаление поврежденного участка ДНК. Этот вид репарации не столь специфичен в отношении повреждений ДНК, как фотореактивация, и с его помощью могут исправляться не только пиримидиновые димеры, но и многие другие изменения структуры ДНК. Эксцизионная репарация (рис. 2.5, А) представляет собой многоэтапный процесс и включает следующие события:
1) узнавание повреждения в ДНК, которое осуществляется специфическими эндонуклеазами, выполняющими и следующую стадию;
2) надрезание одной цепи ДНК вблизи повреждения — инцизия (осуществляют эндонуклеазы);
3) удаление группы нуклеотидов вместе с повреждением — эксцизия (осуществляют экзонуклеазы);
4) ресинтез ДНК — заполнение образовавшейся бреши (ДНК-полимеразная активность);
5) восстановление непрерывности репарируемой цепи за счет образования ковалентных связей сахарофосфатного остова молекулы.
Лучше всего механизм эксцизионной репарации изучен на примере темнового удаления пиримидиновых димеров из ДНК E. coli, облученных ультрафиолетом. В клетках кишечной палочки за данный процесс отвечают гены uvrA-D (кодируют структуру ферментов, вырезающих участок цепи ДНК с димером), а также polА (определяет структуру ДНК-полимеразы I, осуществляющую репартивный синтез ДНК). Особенностью такого способа эксцизионной репарации является образование одноцепочечных надрезов по обе стороны тиминового димера.
Некоторые организмы используют для репарации повреждений, в том числе связанных с образованием тиминовых димеров, еще одну разновидность эксцизионной репарации, предусматривающую участие в процессе особого фермента — N-гликозилазы. В данном случае первым репаративным событием является расщепление гликозидной связи между поврежденным основанием (например, одним из тиминов в димере, N-алкилированным пурином и др.) и дезоксирибозой. Таким образом, имеет место локальная апуринизация, или апиримидинизация; возникает так называемый АР-сайт, узнаваемый АР-специфической эндонуклеазой, которая расщепляет фосфоди эфирную связь рядом с АР-сайтом. Затем брешь заполняется с помощью обычного репаративного синтеза.
В бактериальных и эукариотических клетках обнаружен целый ряд различных N-гликозилаз. Например, урацил-ДНК-гликозилаза узнает неправильную пару dG/dU, возникшую в результате спонтанного дезаминирования остатка дезоксицитозина из пары dG/dC. Дезаминирование цитозина может привести при репликации к возникновению мутантной нуклеотидной пары dA/dT, поскольку с точки зрения образования водородных связей урацил ведет себя аналогично тимину. Другой, широко распространенный фермент подобного типа, представляет собой пиримидиновый димер-N-гликозилазу, которая создает апиримидиновый сайт при репарации повреждений, связанных с образованием пиримидиновых димеров.
Сайты, в которых произошла депуринизация или депиримидинизация, выщепляются ферментами АР (апуриновые и апиримидиновые)-эндонуклеазами. В клетках про- и эукариот имеется много разнообразных АР-эндонуклеаз. Некоторые из них надрезают цепь с 3’-стороны АР-сайта, а другие расщепляют диэфирную связь с 5’-стороны; в любом случае образуются 3’-гидроксильный и 5’-фосфорильный концы. Это позволяет экзонуклеазе удалить прилегающие остатки по обе стороны надреза вместе с повреждением.
Различные варианты эксцизионной репарации широко распространены у про- и эукариотических организмов, в том числе у млекопитающих. Нарушения процессов эксцизионной репарации могут приводить к драматическим последствиям. Так, у людей известно наследственное заболевание — пигментная ксеродерма, основными симптомами которого является повышенная чувствительность к солнечному свету, приводящая к развитию рака кожи. У этих больных обнаружены различные дефекты эксцизионной репарации.
Пострепликативная репарация. Этот тип репарации требует участия продуктов генов, задействованных также в рекомбинационных событиях (rec-гены), и не осуществляется в клетках rec-мутантов, поэтому его называют еще и рекомбинационной репарацией. Рекомбинционная пострепликативная репарация основана на процессах репликации и рекомбинации поврежденной ДНК, она наименее специфична из всех рассмотренных типов репарации, поскольку в ней отсутствует этап узнавания повреждения. Это довольно быcтрый способ восстановления нативной структуры ДНК в дочерних (вновь синтезированных) цепях: показано, что репарация происходит уже в первые минуты после облучения. Особенностью данного процесса является сохранение повреждения в исходных (материнских) цепочках (рис.2.5, Б).
Наряду с быстрой существует и медленная пострепликативная репарация, для которой требуется несколько часов. Ее производит система ферментов, которая отсутствует в необлученных клетках и которую индуцирует облуче- ние. Этот механизм получил название SOS-репарации. Его удивительным отличием является значительное увеличение частоты мутаций, несмотря на то что ДНК и так уже повреждена. Это может являться следствием использования в качестве матрицы цепи ДНК, содержащей повреждения.
Пострепликативная репарация существует не только у бактерий, но и в клетках эукариот, в том числе у млекопитающих.
Дата добавления: 2016-05-30; просмотров: 3258;











