Инструментальные методы анализа
В последние годы все более широкое применение получают инструментальные методы анализа, обладающие многими достоинствами: быстротой анализа, высокой чувствительностью, возможностью одновременного определения нескольких компонентов и использования компьютеров для обработки результатов анализа. Подробное рассмотрение инструментальных методов анализа выходит за пределы данного курса. Это предмет аналитической химии. Остановимся лишь на некоторых методах.
Электрохимические методы анализа. Потенциометрический метод базируется на измерении электродных потенциалов, которые зависят от активности ионов, а в разбавленных растворах – от концентрации ионов.
Потенциалы металлических электродов определяются уравнением Нернста
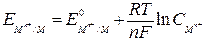 (или
(или 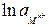 ).
).
Соответственно по значению потенциала можно судить о концентрации ионов.
Полярография. Сущность этого метода заключается в том, что исследуемый раствор подвергают электролизу при высоком напряжении, подаваемом на электроды, и фиксируют изменение силы тока, проходящего через раствор.
Прибор, который позволяет равномерно увеличивать напряжения и регистрировать силу проходящего тока, называется полярографом, а получаемый график зависимости силы тока от напряжения полярограммой.
Сила предельного тока или высота полярографической волны характеризует концентрацию определяемых ионов в растворе.
Полярографический метод позволяет определять концентрацию нескольких ионов в растворе.
Оптические методы анализа.Эти методы основаны на измерении оптических свойств веществ и излучений, взаимодействия электромагнитного излучения с атомами или молекулами анализируемого вещества, вызывающего излучение, поглощение или отражение лучей.
Методы, основанные на изучении спектров излучения, получили название эмиссионных спектральных методов анализа. В методе эмиссионной спектроскопии проба вещества нагревается до очень высоких температур (2000-15000˚С). Вещество, испаряясь, диссоциирует на атомы или ионы, которые дают излучение. Проходя через спектрограф, излучение разлагается на компоненты в виде спектра цветных линий. Сравнение этого спектра со справочными данными о спектрах элементов позволяет определить вид элемента, а по интенсивности спектральных линий – количество вещества.
Разновидностью эмиссионного анализа является эмиссионная пламенная фотометрия, в которой исследуемый раствор вводят в пламя горелки. По изменению цвета пламени судят о виде вещества, а по интенсивности окрашивания пламени – о концентрации вещества.
Методы, основанные на свечении анализируемого вещества под воздействием ультрафиолетовых (фотолюминесценция), рентгеновских (рентгенолюминесценция) и радиоактивных (радиолюминесценция) лучей называются люминесцентными.
Методы, основанные на изучении спектров поглощения лучей анализируемыми веществами, получили название абсорбционно-спектральных. При прохождении света через раствор свет или его компоненты поглощаются или отражаются. По величине поглощения или отражения лучей судят о природе и концентрации вещества.
В соответствии с законом Бугера-Ламберта-Бера зависимость интенсивности потока света, прошедшего через раствор, от концентрации окрашенного вещества в растворе с, выражается уравнением.
 ,
,
где 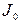 и
и  – интенсивность потока света, падающего на раствор и прошедшего через раствор;
– интенсивность потока света, падающего на раствор и прошедшего через раствор;
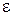 – коэффициент поглощения света, зависящий от природы растворенного вещества;
– коэффициент поглощения света, зависящий от природы растворенного вещества;
 – толщина слоя светопоглощающего раствора.
– толщина слоя светопоглощающего раствора.
Измерив изменение интенсивности потока света, можно определить концентрацию анализируемого вещества. Определение ведут с помощью спектрофотометров и фотоколориметров.
В спектрофотометрах используют монохроматическое излучение, в фотоколориметрах – видимый свет.
Если измеряют поглощение лучей атомами определяемого компонента, которые получают распылением раствора анализируемого вещества в пламени горелки, то метод называют атомно-абсорбционным (атомно-абсорбционная спектроскопия). Метод позволяет анализировать вещества в очень малых количествах.
Оптический метод, основанный на отражении света твердыми частицами, взвешенными в растворе, называется нефелометрическим.
Кондуктометрия.Электрическая проводимость разбавленных растворов пропорциональна концентрации электролитов. Поэтому, определив электрическую проводимость и сравнив полученное значение со значением калибровочного графика, можно найти концентрацию электролита в растворе. Методом кондуктометрии, например, определяют общее содержание примесей в воде высокой чистоты.
Хроматографический анализ. Анализ основан на хроматографии, позволяющей разделять двух- и многокомпонентные смеси газов, жидкостей и растворенных веществ методами сорбции в динамических условиях. Анализ проводится с помощью специальных приборов – хроматографов. Молекулярная хроматография основана на различной адсорбируемости молекул на адсорбентах, ионообменная хроматография – на различной способности к обмену ионов раствора. В осадительной хроматографии используется различная растворимость осадков, образуемых компонентами анализируемой смеси при взаимодействии с реактивами, нанесенными на носитель. Распределительная хроматография базируется на различном распределении веществ между двумя несмешивающимися жидкостями.
К достоинствам хроматографического метода анализа относятся быстрота и надежность, возможность определения нескольких компонентов смеси или раствора.
СПИСОК ЛИТЕРАТУРЫ
1. Коровин Н. В. Общая химия: Учеб. для технических направ. и спец. вузов / Н. В. Коровин. – 8-е изд., стер. – М.: Высш. шк., 2007. – 557 с.: ил.
2. Вольхин В. В. Общая химия: учеб. пособие: в 3 кн. Кн. 1. – Основной курс. / В. В. Вольхин. – Пермь, 2006. – 464 с.
3. Вольхин В. В. Общая химия: учеб. пособие: в 3 кн. Кн. 3. Избранные главы. / В. В. Вольхин. – Пермь, 2006. – 380 с.
4. Ахметов Н. С. Общая и неорганическая химия. Учеб. для вузов. – 4-е изд., испр. / Н. С. Ахметов – М.: Высш. шк. Изд. Центр «Академия», 2001. – 743 с., ил.
5. Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия: Учебник для вузов. / М. Х. Карапетьянц, С. И. Дракин – 4-е изд., стер. – М.: Химия, 2000, 592 с.: ил.
6. Никольский А.Б. Химия. / А. Б. Никольский, А. В. Суворов. – СПб.: Химиздат, 2001. – 512 с.
7. Угай Я. А. Общая и неорганическая химия. / Я. А. Угай. – М.: Высш. шк., 1997. – 527 с.
8. Глинка Н. Л., Задачи и упражнения по общей химии. / Ред. В. А. Рабинович. – М.: Интеграл-Пресс, 2003. – 240 с.
9. Задачи и упражнения по общей химии: учеб. пособие / Б. И. Адамсон, О. Н. Гончарук, В. Н. Камышова и др.; Под ред. Н. В. Коровина. – М.: Высш. шк., 2003. – 255 с.: ил.
10.Краткий справочник физико-химических величин. Изд. 10-е, испр. и дополн. / Под. ред. А. А. Равделя и А. М. Пономаревой – СПб.: Иван Федоров, 2002. – 240 с.

Дата добавления: 2020-03-21; просмотров: 510;











