Количественный анализ. Химические методы анализа
Определение содержания (концентрации, массы) компонентов в анализируемом веществе называется количественным анализом.
С помощью количественного анализа выявляют массовые соотношения компонентов в анализируемом образце, концентрацию вещества в растворе или в газе. При количественном анализе измеряют те или иные химические, физико-химические и физические параметры анализируемого образца, которые зависят от его состава или содержания того или иного компонента.
Количественный анализ проводят в определенной последовательности, в которую входит отбор и подготовка проб, проведение анализа, обработка и расчет результатов анализа.
Как и в качественном анализе различают макрометоды, полумикрометоды, микро- и ультрамикрометоды. Количественный анализ широко используется для изучения состава руд, металлов, неорганических и органических соединений. В последние годы особое внимание обращается на определение содержания токсичных веществ в воздухе, водоемах, почвах, в продуктах питания, различных товарах.
Все методы количественного анализа можно разделить на две большие группы: химические и инструментальные. Это разделение условно, так как многие инструментальные методы основаны на использовании химических законов и свойств веществ. Обычно количественные методы анализа классифицируют по измеряемым физическим или химическим свойствам.
Гравиметрический метод. Сущность метода заключается в получении труднорастворимого соединения, в которое входит определяемый компонент.
Для этого навеску вещества растворяют в растворителе обычно в воде, осаждают с помощью реагента, образующего с анализируемым соединением малорастворимое соединение с низким значением ПР. Затем после фильтрования осадок высушивают, прокаливают и взвешивают. По массе вещества находят массу определяемого компонента и проводят расчет его массовой доли в анализируемой навеске.
Титриметрический анализ.Сущность метода заключается в измерении объема раствора того или иного реагента, израсходованного на реакцию с анализируемым компонентом. Для этих целей используют титрованные растворы, концентрации которых (обычно титр раствора) известны.
Титром называется масса вещества, содержащаяся в 1 мл титрованного раствора.
Определение проводят титрованием, то есть постепенным приливанием титрованного раствора к раствору анализируемого вещества, объем которого точно измерен.
Титрование прекращается при достижении точки эквивалентности, то есть достижения эквивалентности реагента титруемого раствора и анализируемого компонента.
Различают:
1. Кислотно-основное титрование – в его основе лежит реакция нейтрализации
 .
.
Метод позволяет определить концентрацию кислоты или катионов, гидролизующихся с образованием ионов водорода, титрованием раствором щелочи или определить концентрацию оснований, в том числе анионов, гидролизующихся с образованием гидроксид-ионов титрованием растворами кислот. Точка эквивалентности устанавливается при помощи кислотно-основных индикаторов, изменяющих окраску в определенном интервале рН.
2. Осадительное титрование – анализируемый раствор титруется реагентом, образующим с компонентом титрованного раствора малорастворимое соединение. Точка эквивалентности определяется с помощью индикатора, образующего с реагентом окрашенное соединение, например, красный осадок Ag2CrO4 при взаимодействии индикатора K2CrO4 с избытком ионов Ag+ при титровании раствора хлорида раствором нитрата серебра.
3. Комплексонометрическое титрование. При комплексонометрическом титровании определяемый компонент в растворе титруется раствором комплексона, чаще всего этилендиаминтетрауксусной кислоты (ЕДТА, комплексона II) или его двунатриевой соли (комплексона III или трилона Б).
4. Окислительно-восстановительное титрование. Данный способ заключается в титровании раствора восстановителя титрованным раствором окислителя или в титровании раствора окислителя титрованным раствором восстановителя. В качестве титрованных растворов окислителей нашли применение растворы перманганата калия KMnO4 (перманганатометрия), дихромата калия K2Cr2O7 (дихроматометрия), иода I2 (иодометрия). Из титрованных растворов восстановителей следует отметить растворы гидразина N2H4 (гидразинометрия).
При перманганатометрическом титровании в кислой среде 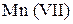 (малиновая окраска) переходит в
(малиновая окраска) переходит в 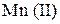 (бесцветный раствор).
(бесцветный раствор).
Например, перманганатометрическим методом можно определить содержание нитритов в растворе:
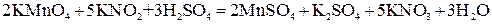 .
.
Дата добавления: 2020-03-21; просмотров: 533;











