Формирование эндоэкологии
Внутренняя экология характерна для вида в целом, вместе с тем она индивидуальна. Первоначально в онтогенезе внутренняя экология формируется в до-иммунный период, т. е. в ранний постнатальный период на фоне иммунологической толерантности организма, и затем в период более позднего постнатального развития фиксируется. Аутохтонная (собственная) микрофлора отличается от транзиторной (случайной) иммунологическими взаимоотношениями как с лидирующим хозяином, так и с этой случайной флорой. Доминирующие группы микроорганизмов осуществляют иммунологическую защиту от случайной микрофлоры. Сама аутохтонная микрофлора имеет механизмы, предупреждающие колонизацию занятых ею ниш обитания.
Возможно, незрелорождающиеся млекопитающие, первоначально не обладающие иммунной защитой, наряду с недостатками обладают и определенными преимуществами. К числу последних следует отнести возможность формирования определенного симбиоза бактерий и простейших с макроорганизмом. Вскоре после рождения иммунологические «ворота» закрываются, и сообщество, сформированное в начале жизни, приобретает барьер, включающий иммунные и другие механизмы защиты. Но так как в раннем онтогенезе во многих случаях организм находится в специальных условиях и контактирует с особями своего вида, то происходит в значительной степени селективное заселение потомства микроорганизмами, причем симбионты в большинстве случаев не являются случайными. Существуют сведения, что, например у термитов и ряда других насекомых, самка вводит чистую бактериальную культуру стерильному потомству. Ясно, что в этом случае создаются условия, с одной стороны, для вариации состава симбионтов, а с другой - для поддержания его постоянства на протяжении многих поколений насекомых в зависимости от стабилизирующего или дивергирующего действия естественного отбора.
У млекопитающих заражение микроорганизмами (контаминация) происходит, как правило, при прохождении новорожденного через родовые пути матери и при вскармливании его молоком. Известно, что, как недавно отметил Р. Фуллер (Fuller, 1985), здоровье детей, вскормленных грудью, значительно лучше, чем получающих молоко из специальной посуды. Этот пример важен также как демонстрация того, что для поддержания определенного состава бактериальной флоры необходимо ее поступление извне. (Р.Фуллер справедливо считает основоположником этого направления И. И. Мечникова.) Имеются опасения, что в условиях космического полета у космонавтов может происходить уменьшение как притока бактерий из окружающей среды, так и их разнообразия. В результате этого может иметь место обеднение микрофлоры. Поэтому идея бактериальных добавок к пище человека чрезвычайно важна и плодотворна.
3.5.2. Основные физиологические функции кишечной бактериальной флоры
В этом разделе мы рассмотрим результаты физиологической активности бактериальной флоры. Такое рассмотрение оправдано как важностью задач, так и тем, что исследование микрофлоры желудочно-кишечного тракта в последнее время позволило значительно продвинуться в понимании сущности процессов питания. Легче всего можно судить о роли бактериальной флоры в организме путем сопоставления безмикробных (стерильных) и обычных животных. Оказалось, что безмикробные животные - это функционально неполноценные организмы, которые, по-видимому, в естественных условиях не имеют шансов на выживание (обзоры: Вальдман, 1972; Germfreeresearch..., 1973; Сравнительная физиология..., 1977; Stanieretal., 1979; Чахава и др., 1982; Пищевые волокна, 1986; Simon, Gorbach, 1987, и др.).
Согласно теории сбалансированного питания, заселение бактериальной флорой пищеварительного тракта высших организмов - нежелательный и в определенной мере вредный побочный эффект. Однако бактериальная флора желудочно-кишечного тракта не только не вредна, но необходима для нормального развития физиологических функций макроорганизма, и его филогенетическое и онтогенетическое развитие тесно связано с биоценозом микроорганизмов.
Следует отметить, что микрофлора оказывает существенное влияние на структурные характеристики кишечника и других органов. У безмикробных организмов масса тонкой кишки меньше, чем у обычных, так как эпителий тоньше и редуцирован примерно на 30%, а ворсинки уже. Более тонкая стенка тонкой и толстой кишки отмечена у безмикробных морских свинок, мышей, цыплят, поросят, крыс, кроликов. Выраженные изменения наблюдаются и в слепой кишке безмикробных животных, причем у грызунов масса расширенной слепой кишки и содержимого может составлять до 25-30% массы тела. Предполагается, что такое увеличение слепой кишки обусловлено отсутствием микробов в организме хозяина и частично - влиянием диеты. У безмикробных животных снижены митотическая активность эпителиальных клеток тонкой кишки и продолжительность их жизненного цикла, а время миграции клеток из области крипт на вершину ворсинок увеличено примерно в 2 раза. Многие исследователи отмечали гипоплазию лимфатических узлов у безмикробных животных и снижение функциональной активности их клеток (обзоры:Haenel, Schulze,1979; Чахава и др., 1982; Simon, Gorbach, 1987, и др.).
Микрофлора пищеварительного аппарата оказывает влияние и на его функциональные характеристики. В частности, бактериальные энтеротоксины существенно влияют на кишечную проницаемость. В большинстве случаев ферментативная активность тонкой кишки у безмикробных организмов выше, чем у обычных. Тем не менее существуют сведения, что уровень дисахаридазной активности тонкой кишки безмикробных и обычных крыс одинаков. Столь же противоречивы сведения и в отношении панкреатических ферментов. По одним данным их активность у безмикробных животных выше, чем у обычных, по другим - она одинакова. Следует, наконец, заметить, что дисбактериозы приводят к снижению ферментативной активности тонкой кишки и соответственно к нарушениям мембранного пищеварения (обзор: Уголев, 1985).
Кишечная микрофлора определяет отношение к иммунной защите организма (обзоры:Germfreeresearch..., 1973; Freter, 1974; Чахава и др., 1982; Пищевые волокна, 1986; Kagnoff, 1987, и др.). Дискутируются два механизма местного иммунитета. Первый из них заключается в ингибировании адгезии бактерий к кишечной слизи, медиированной локальными антителами, включая IgA. Второй механизм состоит в контроле численности определенной бактериальной популяции, локализованной на поверхности кишечной слизистой, за счет присутствия в этой области антибактериальных антител. По сравнению с обычными животными у безмикробных организмов содержится лишь 10% клеток, продуцирующих IgA, который участвует в местном иммунитете. При этом продемонстрировано, что содержание в плазме крови общего белка, α-, β- и γ-глобулинов у безмикробных животных ниже, чем у обычных. В отсутствие обычной микрофлоры при нормальном фагоцитозе у микро- и макрофагов гидролиз ими антигенов замедляется.
Кроме механизмов местного иммунитета, регулирующего микрофлору кишечника, существует еще один механизм контроля - бактериальный антагонизм, за счет которого может предупреждаться рост связанной с кишечной слизистой определенной популяции бактерий.
Под влиянием бактериальной флоры, как указано выше, в пищеварительном аппарате образуются некоторые токсины. Это доказывается тем, что образование аминов и, как следствие, уровень их экскреции у безмикробных организмов весьма низки. Этот уровень заметно увеличивается после заражения организмов одной или несколькими группами бактерий. В частности, моноинфекция безмикробных мышей культурой Clostridiumperfringensприводит к увеличению уровня гистамина, особенно в полости слепой кишки (Lindbladetal., 1979).
Экскреция пиперидина рассматривается как индекс изменений микрофлоры при колонизации кишечника и при переходе от молочного к дефинитивному питанию. Экскреция этого амина в норме у людей разных возрастных групп различна. Существуют данные, что у детей одного возраста (4-6 мес.), питающихся грудным молоком, уровень пиперидина в моче значительно ниже: (1.65±0.55) ммоль/моль креатинина, чем у детей, получающих добавки,- (5.95±0.56). Увеличивается также уровень пиперидина при ряде заболеваний. Так, если у детей концентрация пиперидина в моче в норме составляет (1.11±0.95) ммоль/моль креатинина, то при целиакии - (3.62±1.40), т. е. почти в 3 раза выше (Lindbladetal., 1979). Эти сведения совпадают с данными об увеличении экскреции тирамина при малабсорбции, вызванной рядом заболеваний.
Как уже было отмечено, по-видимому, в ходе эволюции некоторые токсические амины включились в регуляторные системы организма. Примером этому могут служить упомянутый выше гистамин и серотонин, образующиеся при декарбоксилировании аминокислот. Бактериальная флора кишечника оказывает влияние на пищевые волокна. Детальная характеристика трансформации таких волокон под действием главным образом анаэробной микрофлоры толстой кишки человека дана в обзоре У. Каспари с соавторами (Casparyetal., 1981). Переход от физиологического к патологическому состоянию происходит, насколько можно судить, преимущественно за счет усиления ферментативных процессов. Как замечают авторы, те процессы, которые в толстой кишке человека могут быть причиной болезней, в желудке жвачных и многих травоядных животных являются основными для утилизации грубых кормов, недоступных ферментам животного происхождения. По-видимому, при ферментативной обработке происходит одновременно огромное количество различных химических реакций. В связи с этим их точная запись невозможна. Приближенная формула дается многими авторами (в том числе У. Каспари идр.): 115 (С6 Н12 О6 ) →130уксуснаякислота + 40 пропионовая кислота + 30п-маслянаякислота + 70СН4 + 120 СО2 + 50 Н2О.
Следует, однако, иметь в виду, что при анаэробной ферментации образуются также (чаще в качестве индивидуальных продуктов) муравьиная, янтарная и молочная кислоты и некоторое количество водорода. Определение водорода широко используется для диагностики заболеваний тонкой и особенно толстой кишки.
Таким образом, бактериальная флора желудочно-кишечного тракта является своеобразным трофическим гомеостатом, или трофостатом, обеспечивающим разрушение избыточных компонентов пищи и образование недостающих продуктов. Кроме того, некоторые продукты ее жизнедеятельности принимают участие в регуляции ряда функций макроорганизма. Поэтому поддержание нормальной бактериальной флоры в организме становится одной из важнейших задач оптимизации питания и жизнедеятельности высших организмов, и в том числе человека.
Кроме популяции бактерий, живущих в полости желудочно-кишечного тракта, существует также бактериальная флора, связанная со слизистой оболочкой тонкой кишки. Способность различных бактерий находиться в тесном контакте со структурами кишечной поверхности была продемонстрирована на примере мышей еще в 1965 г. Затем было выявлено, что в одних случаях аутохтонные микроорганизмы не вызывают видимых изменений в структуре кишечных клеток, тогда как в других, напротив, нарушают ее. Примером последних могут служить сегментированные нитевидные микробы, нарушающие мембрану кишечных клеток. Эти же микроорганизмы (спирохеты и спиралевидные бактерии), ассоциируясь с кишечной клеткой одним своим концом, другим раздвигают микроворсинки, разрушая гликокаликс и щеточную кайму (обзор:Чахава идр., 1982).
Бактериальная популяция кишечной слизистой оболочки существенно отличается от полостной как по составу, так и по биохимическим характеристикам. В нашей лаборатории еще в 1975 г. было показано, что среди популяции бактерий слизистой оболочки тонкой кишки почти отсутствуют гемолизирующие формы, которые широко представлены в полостной популяции. Уже в то время нами было высказано предположение, что мукозная популяция является аутохтонной и в значительной мере определяет состав полостной популяции. В то же время выявлено, что при изменении диеты и заболеваниях наблюдаются более резкие нарушения мукозной популяции, а не полостной (обзор: Уголев, 1985).
Идея И.И. Мечникова о целесообразности подавления кишечной бактериальной флоры в настоящее время должна быть подвергнута коренному пересмотру. Действительно, как уже отмечалось, сопоставление обычных и безмикробных организмов позволило заключить, что последние в метаболическом, иммунологическом и даже нейрологическом отношении дефектны и резко отличаются от обычных. Так, у безмикробных животных недоразвита иммунная защитная система, они более чувствительны к недостаткам рациона, в частности к рационам с недостаточностью незаменимых аминокислот и витаминов. В зависимости от питания меняется также и состав микрофлоры. Например, замена белка на смесь аминокислот вызывает снижение количества бифидобактерий у взрослых людей, как и у детей при добавлении к грудному молоку коровьего молока. На примере крыс обнаружено, что неблагоприятные изменения микрофлоры, в том числе снижение количества лактобацилл и увеличение числа стафилококков, в основном имеют место при олигомерном, но не полимерном питании (обзор: Уголев, 1985).
Когда исследования проводились не на безмикробных животных, а на людях, которые в силу каких-либо причин со дня рождения были отделены от окружающей среды и не имели собственной бактериальной флоры, то оказалось, что их пищевые потребности также существенно отличались от таковых у обычных людей.
Как уже было отмечено, симбиоз микро- и макроорганизмов, вероятно, является древним эволюционным приобретением и наблюдается уже на уровне примитивных многоклеточных организмов. Во всяком случае в ходе эволюции у большинства многоклеточных организмов возник симбиоз с бактериями определенных типов. В самом деле, бактериальная флора представляет собой необходимый атрибут существования сложных организмов. Последние, по современным представлениям, следует рассматривать как единую систему более высокого иерархического уровня, чем отдельный индивидуум. При этом макроорганизм по отношению к микроорганизмам выполняет функцию доминанта и регулятора всей системы в целом. Между ним и симбионтами существует обмен метаболитами, в состав которых входят нутриенты, различные неорганические компоненты, стимуляторы, ингибиторы, гормоны и другие физиологически активные соединения. Подавление бактериальной флоры кишечника часто приводит к сдвигу метаболического баланса организма.
Таким образом, в настоящее время становится ясно, что в метаболическом смысле организм представляет собой надорганизменную систему, состоящую из доминирующего многоклеточного организма и специфической бактериальной поликультуры, а иногда и Protozoa. С этой точки зрения существенно, что определенная часть витаминов и незаменимых аминокислот, в которых нуждается организм высших животных и человека, поступает за счет бактерий. Действительно, как отмечено выше, у безмикробных животных недостаток витаминов или незаменимых аминокислот приводит к более тяжелым и скорее проявляющимся нарушениям, чем у обычных. Следовательно, с позиций теории адекватного питания можно говорить не только об экологии в целом, но и о микроэкологии, или более правильно - об эндоэкологии многоклеточных организмов, которая, как мы отмечали, формируется очень рано.
Эндоэкосистемы обладают способностью к саморегуляции и в достаточной мере устойчивы. Вместе с тем они имеют некоторые критические пределы устойчивости, за которыми наступает их непоправимое нарушение. Нормальная эндоэкология может быть нарушена при специфических и неспецифических воздействиях, что может приводить к резкому изменению потока бактериальных метаболитов (рис. 3.2). Нарушение состава бактериальной популяции кишечника обнаружено, в частности, при изменении состава рациона, при заболеваниях желудочно-кишечного тракта, под влиянием различных экстремальных факторов (например, при стрессах, в том числе эмоциональных, при специальных условиях и т. д.). Дисбактериозы, возникающие по разным причинам, в частности вследствие применения антибиотиков, провоцируют многие вторичные нарушения, меняют реактивность организма, вызывают скрытые патологии и т. д.
Формирование представлений об эндоэкологии человека и других организмов имеет фундаментальное значение, а сохранение микрофлоры и предупреждение ее нарушений - одна из важных задач биологии и медицины.
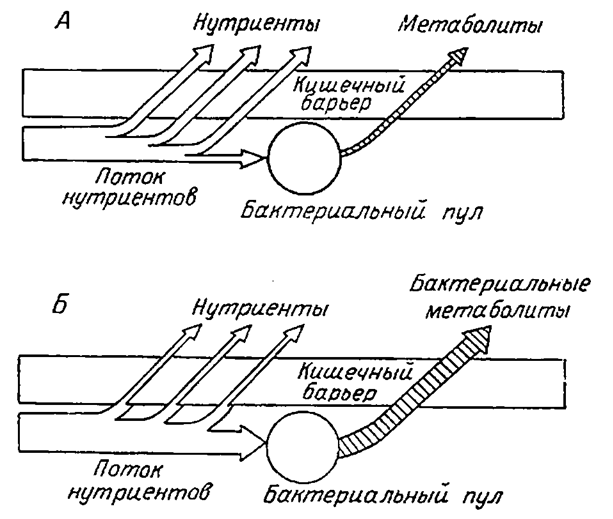
| Рис. 3.2. Соотношение между первичными нутриентами и бактериальными метаболитами при физиологических (А) и патологических (Б) состояниях организма (дефекты переваривания и всасывания) (по Уголев, 1985). |
3.5.3. Бактериальная флора как трофический гомеостат - трофостат
По-видимому, бактериальная флора желудочно-кишечного тракта выполняет функцию химического гомеостата. При сохранении у грызунов копрофагии значительная часть пищи подвергается различным трансформациям вследствие размножения бактерий, являющихся важным источником пищевого материала. Следовательно, определенная часть пищевой смеси будет представлена не исходными, компонентами соответствующей диеты, а самими бактериями. Кроме того, кишечная микрофлора может играть существенную роль в интенсификации продукции пищеварительных ферментов, что имеет решающее значение в случае ферментной недостаточности. Естественно, что такие факторы могут оказывать влияние на характер адаптационной реакции в ответ на ту или иную диету. К такому заключению, в частности, приводят результаты работ нашей лаборатории, представленные в монографиях «Проблемы клинической и экспериментальной энтерологии» и «Мембранный гидролиз и транспорт. Новые данные и гипотезы», опубликованных в 1981 и 1986 гг. Суть их такова.
При сопоставлении данных двух вариантов эксперимента, в первом из которых копрофагия была полностью исключена, а во втором сохранялась, были обнаружены существенные различия. В первом варианте эксперимента были выявлены выраженные приспособительные перестройки ферментного аппарата тонкой кишки крыс при изменении композиции пищи. В другом варианте, где ожидались сходные результаты, адаптивные перестройки были выражены слабо или полностью отсутствовали. Дополнительные опыты показали, что именно в отсутствие копрофагии и имеют место значительные изменения в реакции ферментных систем кишечной трубки на изменение пищевого рациона. При копрофагии наблюдается своеобразное демпфирование пищевых эффектов на ферментативную активность тонкой кишки благодаря тому, что важным компонентом питания крыс являются фекальные бактериальные культуры. В этих опытах с особенной отчетливостью проявилась функция бактериальной флоры как своеобразного буфера, предохраняющего внутреннюю среду организма от внешних «биохимических бурь», связанных с изменением состава пищи. Именно в этой связи мы ввели представление о кишечной флоре как о трофостате.
Важно, что в зависимости от состава бактериальной флоры в желудочно-кишечном тракте и от ее реакции на изменение композиции пищи находится и реакция макроорганизма, который в этих условиях образует вместе с бактериальной флорой единую надсистему.
3.5.4. Эндоэкология, внешние и внутренние трофические цепи
Когда мы вводили представление об эндоэкологии, мы исходили из общих концепций биологии и экологии и, в частности, из того, что в экосистеме существенную роль должны играть трофические цепи. Есть много убедительных доказательств реального существования таких трофических цепей во внутренних, а не только внешних экосистемах. Во внутренних цепях участвуют главным образом бактерии, но также растения, грибы и животные (в особенности простейшие), занимающие в трофических цепях различные места. В частности, было показано, что в пищеварительной системе термитов и некоторых других насекомых основными потребителями целлюлозы являются не бактерии, а определенные группы жгутиконосцев. Уничтожение этих простейших в эксперименте приводило к полной потере термитами способности питаться древесиной. Кроме того, у термитов и некоторых других беспозвоночных были обнаружены бактерии, способные фиксировать атмосферный азот (обзор: Schmidt-Nielsen, 1982). Иными словами, были выявлены организмы, стоящие в начале трофический цепи по азотсодержащим компонентам, хотя и нуждающиеся в органических источниках энергии. В то же время в желудочно-кишечном тракте как беспозвоночных, так и позвоночных продемонстрировано присутствие организмов, в особенности бактерий, выполняющих роль деградаторов органического вещества.
Таким образом, в пищеварительном канале были обнаружены различные варианты и звенья тех трофических цепей, которые мы традиционно относим лишь к внешним макроэкосистемам.
3.5.5. Оптимизация и восстановление эндоэкологии
Антибиотики - широко и многократно используемое средство лечения людей и различных сельскохозяйственных животных. Следует думать, что в этом случае даже при исходно нормальной микрофлоре она может быть частично или полностью уничтожена, а затем замещена случайной, следствием чего может быть возникновение различных по форме и степени нарушений. Однако часто такие нарушения могут начинаться значительно раньше из-за неблагоприятных условий, возникающих вследствие неоптимальной флоры, получаемой при рождении. Таким образом, уже сегодня возникают вопросы о способах конструирования и восстановления оптимальной микрофлоры, т. е. микроэкологии, и эндоэкологии организма.
Следует заметить, что, по всей вероятности, в будущем родильные дома будут располагать идеальными бактериальными поликультурами. Последние и будут (возможно, при вскармливании или иным путем) прививаться детям. Не исключено, что эти поликультуры будут собираться у наиболее здоровых матерей. Следует также выявить, будут ли оптимальные поликультуры в различных странах идентичны или должны различаться в связи с климатическими и другими особенностями жизни различных групп людей.
3.6. Элементные диеты и две теории питания
Напомним, что идея элементного (мономерного) питания, возникшая в конце XIX-начале XX в. и вытекающая из теории сбалансированного питания, заключалась в том, что нашу традиционную пищу можно и целесообразно заменить легкоусвояемыми мономерами, имитирующими смесь продуктов питания - белков, углеводов, жиров и др. Считалось, что такая пища вполне удовлетворит потребности организма.
Однако с позиций теории адекватного питания элементные диеты дефектны по многим причинам и, в частности, потому, что нарушают свойства и соотношение нутритивного (трофического) и токсического потоков вследствие выпадения защитных функций мембранного пищеварения и изменения эндоэкологии. Действительно, у моногастричных организмов (в том числе у человека) питание бактерий построено на использовании преимущественно неутилизируемых или медленно утилизируемых макроорганизмами компонентов пищи. Мембранное пищеварение, реализуемое ферментами, локализованными в недоступной бактериям щеточной кайме, препятствует поглощению ими нутриентов и обеспечивает стерильность процесса (Уголев, 1967, 1985). Такую стерильность можно рассматривать как приспособление макроорганизма к сосуществованию с кишечной бактериальной флорой и как фактор, обеспечивающий преимущественное поглощение нутриентов макроорганизмом. Если же пища вводится в организм в виде мономеров, то мембранное пищеварение как защитный механизм не функционирует. В этом случае бактерии оказываются в чрезвычайно благоприятных условиях для их размножения в результате избытка легкоусвояемых элементов в полости тонкой кишки. Это приводит к нарушению эндоэкологии, к увеличению потока токсических веществ и к потере макроорганизмом ряда веществ, в том числе необходимых. При изучении эффектов мономерного питания нами, а затем многими другими исследователями зарегистрированы дисбактериозы и дополнительное дезаминирование аминокислот (обзор: Уголев, 1985).
Далее, имеются многочисленные сведения, касающиеся более быстрого (или идентичного) всасывания в тонкой кишке человека и животных олиго- и полисахаридов по сравнению с составляющими их свободными моносахаридами. Существует также множество данных о больших скоростях всасывания пептидов по сравнению с составляющими их свободными аминокислотами. Особенно интересно, что всасывание ферментных гидролизатов белков, состоящих преимущественно из олигопептидов, происходит быстрее, чем эквивалентной смеси аминокислот, симулирующих эти белки (обзоры: Химические и физиологические проблемы..., 1975, 1976; Silk, 1977; Gardner, 1984, 1988, и др.).
При специальном исследовании аккумуляции углеводов различной степени полимеризации в слизистой оболочке тонкой кишки крыс нами было обнаружено, что транспорт свободной глюкозы не зависит от состава диет, т. е. является стабильным процессом. В отличие от этого транспорт глюкозы, освобождающейся при гидролизе мальтозы и крахмала, значительно меняется и зависит от состава рациона (обзор: Уголев, 1972). Сходные результаты получены в Институте биологии АН Латвии (Рига) на цыплятах (обзор: Кушак, 1983).
Феномен более быстрого транспорта мономеров, образующихся при гидролизе олиго- и полимеров, чем свободных мономеров, может найти объяснение в свете концепции мембранного пищеварения. Эта концепция предполагает пространственную и структурнофункциональную интеграцию заключительных этапов гидролиза и начальных этапов всасывания. Многими принимается, что интеграция реализуется за счет ферментно-транспортных комплексов мембраны, в которых интегрированы один или несколько ферментов и одна или несколько транспортных систем, реализующих трансмембранный перенос продуктов гидролиза. Идея такого комплекса сохраняет свое значение как для концепции мобильного переносчика, так и для гипотезы канала (Уголев, 1972, 1985, 1987а; Membranedigestion..., 1989). В ферментно-транспортном комплексе продукты гидролиза должны непосредственно передаваться с активного центра фермента на вход в транспортную систему мембраны с минимальным рассеиванием в водной фазе, а транспортная система не должна взаимодействовать с мономерами, присутствующими в водной среде (рис. 3.3).
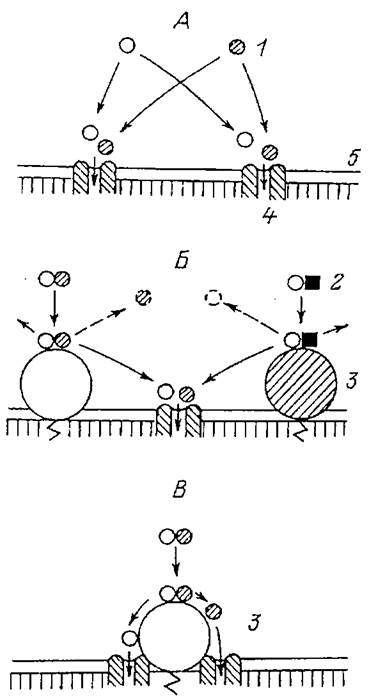
| Рис. 3.3. Роль ферментно-транспортных комплексов в предотвращении конкуренции между мономерами на стадии всасывания (по: Уголев, 1985). А - конкуренция между мономерами за общий вход в транспортную систему; Б- конкуренция между конечными продуктами гидролиза за общий вход в транспортную систему; В - ферментно-транспортный комплекс: передача конечных продуктов гидролиза с фермента на вход в транспортную систему (без конкуренции).1-мономер; 2 - димер; 3 -фермент; 4- транспортнаясистема; 5 - мембрана. |
Существуют отрицательные последствия длительного применения мономерных диет, охарактеризованные в ряде специальных сводок, в том числе в сводках «Химические и физиологические проблемы...», опубликованных в Риге в 1975 и 1976 гг. К таким последствиям относятся, в частности, замедление роста и уменьшение массы тела животных, увеличение экскреции аммиака, уменьшение экскреции электролитов, развитие гемолитической анемии и т. д. Недавно показано также, что при длительном использовании элементных диет происходит трансформация некоторых вводимых в организм лекарственных препаратов в токсические формы (Interactionofelementaldiets..., 1988). Кроме того, мономерные диеты приводят к снижению функциональной нагрузки на ферментные системы желудочно-кишечного тракта, что сопровождается нарушением синтеза ряда ферментов, которые необходимы для нормальной деятельности организма. Далее, из-за высокой осмотической активности элементных диет нарушается распределение жидкости между кровью и энтеральной средой в результате перехода жидкости из крови в кишечник.
Однако при некоторых формах заболеваний и в определенных условиях элементные и безбалластные диеты могут быть весьма полезны. В частности, при врожденных и приобретенных дефектах ферментных систем тонкой кишки наиболее целесообразно исключать из пищи те вещества (например, лактозу, сахарозу и др.), гидролиз которых нарушен. Элементные диеты могут быть использованы при различных экстремальных воздействиях, вызывающих нарушения деятельности желудочно-кишечного тракта. При этом неадекватность, например имитаций белка набором определенных аминокислот, проявляется не сразу, а через определенный временной интервал, в течение которого эти аминокислоты могут служить полноценной заменой белка. Вероятно, отрицательные последствия элементных диет связаны с изменением бактериального состава или по крайней мере с изменением свойств бактериальной популяции кишечника.
Элементные, или мономерные, диеты важны при патологических состояниях, при которых наблюдается репрессия синтеза и включения в состав мембраны кишечных клеток ферментов, осуществляющих заключительные этапы пищеварения. В этом случае всасывания аминокислот и гексоз, входящих в состав олигомеров, не происходит. Такие феномены могут наблюдаться, в частности, под влиянием стрессорных факторов. Тогда аминокислоты могут быть использованы для поддержания удовлетворительного азотистого баланса, отрицательного при стрессе, для которого характерна потеря белков. Такой отрицательный азотистый баланс возникает за счет глюконеогенеза. Мы получили результаты, расширяющие классические представления о происхождении отрицательного азотистого баланса, которые опубликованы в 1972 г. (Уголев, 1972). Нами обнаружено, что при стрессе происходит снижение уровня дисахаридазных и особенно пептидазных активностей тонкой кишки за счет торможения включения ферментов в состав апикальной мембраны кишечных клеток, что приводит к ослаблению ассимиляции углеводов и главным образом белков. Таким образом, при стрессе отрицательный азотистый баланс обусловлен не только разрушением, но и недостаточным поступлением аминокислот во внутреннюю среду организма. Следовательно, при различных видах стресса существует эффективный путь коррекции белкового обмена за счет введения в рацион вместо белков, которые не усваиваются, имитирующих эти белки аминокислотных смесей. Использование подобных смесей целесообразно также в аварийных ситуациях, при чрезмерных физических нагрузках (например, в условиях экспедиций), при спортивных соревнованиях, при хирургических вмешательствах, а также в пред- и послеоперационные периоды, в условиях недостатка белка, при голоде, при высокой или низкой температуре окружающей среды, при ряде заболеваний ит. д., т. е. в случаях, которые сопровождаются возникновением стресса - общей для всех организмов реакции, являющейся неспецифической и рассматриваемой как обязательный компонент реакции на экстремальные воздействия.
Дата добавления: 2016-06-22; просмотров: 2172;











