Законы идеального газа
Рабочим телом простых равновесных термодинамических систем считается идеальный газ. Введение понятия идеального газа позволило составить математические зависимости между параметрами, характеризующими состояние рабочего тела, и на их основе создать теорию термодинамических процессов.
Некоторые законы идеального газа (законы Бойля-Мариотта и Гей-Люссака) были получены экспериментально в начале 19-го века. В настоящее время целесообразнее рассматривать их как следствие из закона состояния идеального газа, экспериментально установленного Клайпероном позже, в 1834 году.
Уравнение Клайперона устанавливает, что для любого идеального газа, в любом его состоянии выполняются равенства:
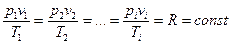
где
p – абсолютное давление [Па];
v – удельный объем [м3/кг];
T – абсолютная температура [К];
R – газовая постоянная;
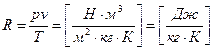
Физический смысл газовой постоянной R
R идеального газа не зависит от параметров, а зависит только от физической природы газа. Она характеризует работоспособность газа. Численно R равна работе, которую совершит 1 кг данного газа, если его нагреть на 1 К при постоянном давлении.
Уравнение состояния идеального газа может встречаться в различных формах записи. Например, уравнение состояния идеального газа массой 1 кг
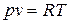
Или для произвольной массы газа (уравнение Менделеева – Клайперона):
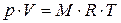
Где М – масса газа, кг.
Или уравнение Менделеева-Клапейрона для одного моля любого газа:
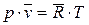
где 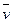 –удельный объем одного моля газа [м3/моль]
–удельный объем одного моля газа [м3/моль]
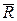 – универсальная газовая постоянная [Дж/мольК]
– универсальная газовая постоянная [Дж/мольК]
Физический смысл универсальной газовой постоянной 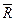
Численно 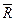 равна работе, которую совершит 1 моль любого газа, если его нагреть на 1 К (при постоянном давлении.
равна работе, которую совершит 1 моль любого газа, если его нагреть на 1 К (при постоянном давлении.
Моль – это единица измерения количества вещества. Один моль - это количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде 12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Упрощая, можно сказать: моль – это фиксированное количество частиц вещества, равное числу Авогадро.
Мольная масса µ – это масса одного моля данного вещества. В таблице Менделеева как правило приводится в размерности [г/моль].
Если воспользоваться следствием из закона Авогадро (моль любого газа при одинаковых р и Т занимает одинаковый объем), то легко можно получить величину универсальной газовой постоянной:
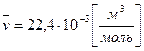
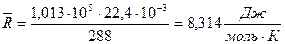
Зная универсальную газовую постоянную, легко рассчитать газовую постоянную любого газа:

где μ – масса моля [кг/моль];
В химической термодинамике (для сложных ТДС) количество вещества в системе часто задают числом молей.

т.о. 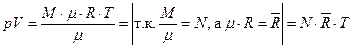
Газовая постоянная идеального газа R не зависит от параметров, а зависит только от физической природы газа. Она характеризует работоспособность газа. Численно R равна работе, которую совершит 1 кг газа, если его нагреть на 1 К при постоянном давлении.
Универсальная газовая постоянная 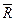 не зависит ни от параметров, ни от природы газа. Универсальная газовая постоянная характеризует работоспособность моля любого газа и численно равна работе, которую совершит моль любого газа, если его нагреть на 1 К при постоянном давлении.
не зависит ни от параметров, ни от природы газа. Универсальная газовая постоянная характеризует работоспособность моля любого газа и численно равна работе, которую совершит моль любого газа, если его нагреть на 1 К при постоянном давлении. 
Газовая постоянная – важнейшая характеристика рабочего тела. По её величине можно оценить работу, которую можно получить с данного газа в принципе.
Например, сравним водород (Н2) и углекислый газ (СО2).
Мольные массы:
µН = 1 г/моль; µС = 12 г/моль; µО = 16 г/моль.
для Н2 R=8314/(1*2)=4157Дж/кгК,
для СО2 R=8314/(12+16*2)=188,95Дж/кгК.
Следовательно, с 1 кг Н2 в равных условиях можно получить в 22 раза большую работу (4157/188,95=22), чем с СО2.
Дата добавления: 2020-03-21; просмотров: 870;











