ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ РАЗВИТИЯ БРОНХИАЛЬНОЙ АСТМЫ
Повседневная практика убеждает в том, что развитие бронхиальной астмы является результатом воздействия генетических факторов и условий внешней среды. Справедливым является обобщение, сделанное О.М.Елисеевым [1] о том, что «...во всех заболеваниях, исключая травмы, есть та или иная доля влияния генетических факторов». Существенная роль наследственности была представлена, в частности, в классических клинических отечественных работах, посвященных детской бронхиальной астме [2, 3,4,8,9]· По данным этих работ, наследственная отягощенность аллергическими заболеваниями выявляется у 48—68,8% больных. Если оба родителя ребенка болеют бронхиальной астмой, то вероятность развития у него астмы превышает 60%. Несмотря на усилия, предпринятые за последние 25—30 лет в исследовании наследственности при бронхиальной астме, четкого представления о генетике этого заболевания не выработано. Вместе с тем получены результаты, достаточно хорошо ассоциированные с современными представлениями о механизмах развития заболевания. В настоящей работе суммированы основные факты, полученные к моменту ее написания.
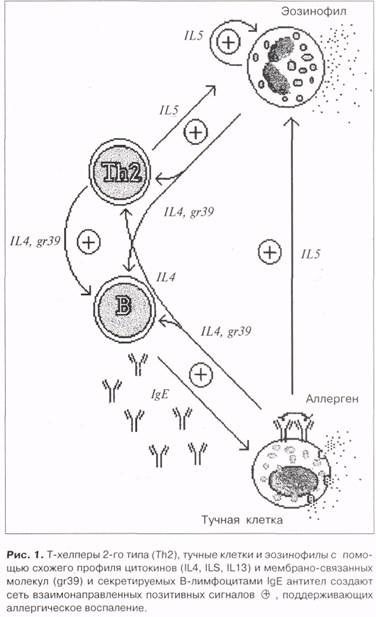
Современная наука рассматривает бронхиальную астму как хроническое воспалительное заболевание стенок дыхательных путей [5]. Аллергические и неаллергические механизмы могут приводить к схожим гистологическим изменениям, наиболее типичными из которых являются инфильтрация воспалительными клетками (лим-фоидные клетки, эозинофилы, тучные и др.), утолщение базальной мембраны слизистой оболочки, повреждение, десквамация эпителия. В процессе астматического воспаления лимфоциты, контролирующие продукцию антител, вырабатывают ре-гуляторные факторы, приводящие к выработке антител преимущественно класса IgE (интерлейкин (IL-4, IL-13), привлекающие к месту воспаления эозинофилы и способствующие их последующей активации IL-5, G-CSF, GM-CSF). Такие лимфоциты получили название ТН2 лимфоцитов, а секретиру-емые ими биологически активные регуляторные белки (IL-4, IL-13, IL-5) — Th2 профиль цитокинов, Вовлекаемые в воспаление тучные клетки и эозинофилы так же секретируют цитокины Th2 профиля, индуцируя Th2 лимфоциты. Таким образом, создается порочный круг, поддерживающий
характерное воспаление в стенке дыхательных путей (рис. 1) [6,7,18]. С воспалительными изменениями ассоциирована бронхиальная гиперреактивность — типичный функциональный признак бронхиальной астмы. Молекулярные и клеточные феномены, сопровождающие аллергическое воспаление, в настоящее время активно изучаются [7, 13, 16, 18].
Что толкает регулирующие лимфоциты продуцировать именно такой «цитокиновый бульон», который включает специфические для астмы патогенетические механизмы? Это внешние причины (особенности антигена, его количество, представляемое иммунной системе, клеточное окружение во время этого представления) и внутренние, генетически детерминированные факторы.
Наследование астмы (предрасположенности к ней) не является моногенным. Анализ с использованием различных методов свидетельствует в пользу того, что 3 группы признаков, а именно характер сенсибилизации, уровень общего IgE и наличие собственно бронхиальной астмы или бронхиальной гиперреактивности, наследуются независимо друг от друга. Исследование механизмов передачи этих признаков выявило несколько основных классов генов, связанных с бронхиальной астмой. Их можно разделить на 3 группы: 1-я — гены, ассоциированные с выработкой специфических IgE антител по отношению к различным, конкретным аллергенам; 2-я — гены, определяющие продукцию общего IgE, базальный его уровень и 3-я — гены, связанные с конкретным заболеванием, т. е. с бронхиальной астмой. Кроме того, некоторое количество минорных генов могут влиять на фенотипические проявления, связанные с основными генами.
Контроль продукции специфических IgE антител осуществляется классическими генами иммунного ответа, Ir-генами. Существует связь типа сенсибилизации с субвариантами аллелей II класса главного комплекса гистосовместимости (короткое плечо 6q хромосомы 6). Молекулярный анализ выявил значительно более высокие коэффициенты относительного риска развития отдельных видов сенсибилизации с аллелями HLA-DR, HLA-DQ, HLA-DP, по сравнению со стандартным типирова-нием микроцитотоксическим методом. Такие ассо-
циации вначале были обнаружены при сенсибилизации некоторыми пыльцевыми аллергенами, а в дальнейшем — при сенсибилизации многими другими антигенами [10, 20], что представляется следующим образом.
несколько претендентов на роль главного гена, контролирующего интенсивность продукции IgE, независимую от антигенной стимуляции.
| Антиген | Молекула HLA-II |
| A.artemisiifola V и VI; A.trifidaV; A.psilosachia | DRB1-1501 |
| Lolium perenne | DRB1-11 |
| Phleum prateuse V | DRB1-04 |
| D.pteronyssinus 1 и II | DRB1, DRB2, DRB5 |
| D.pteronyssinus II | DRB1-03 |
| Alternaria alternate | DRB1-04 |
| Felis domesticus 1 | DRB1-03 |
Максимального внимания заслуживает группа близко расположенных друг к другу генов, локализованных в длинном плече 5q хромосомы 5. В работах последних лет показана сильная ассоциация концентрации общего уровня IgE с полиморфными маркерами области 5q31.1, в том числе маркерами, локализованными внутри гена IL-4 и рядом с ним. При этом маркеры вне 5q31.1 не выявляют ассоциации с уровнем IgE [21, 22].
Для такой связи есть серьезные теоретические основания. При этом значимой ассоциации генов HLAII класса с нозологической формой «бронхиальная астма», как правило, не обнаруживается; такие данные получены в различных этнических и расовых группах. Некоторые публикации об ассоциации HLAII класса с атонической астмой [3, 19] скорее являются исключением из правила. Нам также удалось проследить эту связь [10], однако поливалентная сенсибилизация, присутствующая в характеристике больных бронхиальной астмой в этих работах, может маскировать ассоциацию вариантов HLA II с чувствительностью к отдельным аллергенам. Выработка специфических IgE антител не связана с общим уровнем IgE и может существенно сказываться на его концентрации лишь у больных с низким базальным уровнем IgE.
Генетический контроль базального уровня (общего) IgE, в свою очередь, связан с предрасположенностью к развитию астмы. Тип наследования уровня общего IgE описан в больших исследованиях, однако характеристики эти различны. Описаны аутосомно-доминантный тип наследования признака «низкий базальный IgE->, рецессивное наследование признака «высокий базальный IgE», кодоминантный тип наследования этих признаков, отсутствие единственного основного контролирующего гена, полигенное наследование. Суммируя эти данные, можно говорить о генетической гетерогенности признака «базальный уровень IgE». Вместе с тем молекулярные исследования выявляют
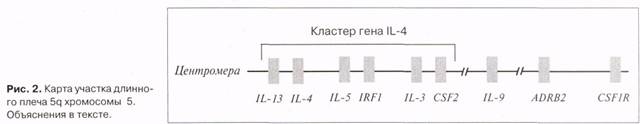
 Как указывалось выше, IL-4 играет ключевую роль в переключении В-клетки на синтез IgE. Кроме того, в этой области генома (5q31.1) находится еще несколько генов, имеющих отношение к механизмам развития аллергии и астмы (рис. 2). Это гены IL-13 (IL-13 продуцируется Th2 лимфоцитами, эффекты совпадают с IL-4), IL-5 (Th2 — цитокин, активирует эозинофилы), IRF1 (ген фактора регуляции интерферона-1), CSF2 (ген, кодирующий гранулоцитарно-моноцитарный колониестимули-рующий фактор, GM-CSF) и IL3 (IL3 и GM-CSF активируют пролиферацию воспалительных клеток, в том числе эозинофилов и нейтрофилов). Необходимо подчеркнуть, что уровень специфических антител класса IgE по отношению к различным аллергенам не ассоциирован с полиморфными маркерами кластера 5q31-3. Таким образом, есть серьезные основания считать, что ген IL-4 или до сих пор неизвестный рядом лежащий ген регулирует продукцию IgE и является одним из генов предрасположенности к астме. Вместе с тем сегрегационный анализ с использованием двулокусной модели, где второй главный локус не сцеплен с ло-кусом на 5q, показал, что такая модель существенно лучше описывает наследование высокого базаль-ного уровня IgE. Недавно группой D.G.Marsh было показано существование региона на хромосоме 12ql5-q24.1, с которым ассоциирован базальный уровень IgE и астма в семьях некоторых малых этнических групп [12].
Как указывалось выше, IL-4 играет ключевую роль в переключении В-клетки на синтез IgE. Кроме того, в этой области генома (5q31.1) находится еще несколько генов, имеющих отношение к механизмам развития аллергии и астмы (рис. 2). Это гены IL-13 (IL-13 продуцируется Th2 лимфоцитами, эффекты совпадают с IL-4), IL-5 (Th2 — цитокин, активирует эозинофилы), IRF1 (ген фактора регуляции интерферона-1), CSF2 (ген, кодирующий гранулоцитарно-моноцитарный колониестимули-рующий фактор, GM-CSF) и IL3 (IL3 и GM-CSF активируют пролиферацию воспалительных клеток, в том числе эозинофилов и нейтрофилов). Необходимо подчеркнуть, что уровень специфических антител класса IgE по отношению к различным аллергенам не ассоциирован с полиморфными маркерами кластера 5q31-3. Таким образом, есть серьезные основания считать, что ген IL-4 или до сих пор неизвестный рядом лежащий ген регулирует продукцию IgE и является одним из генов предрасположенности к астме. Вместе с тем сегрегационный анализ с использованием двулокусной модели, где второй главный локус не сцеплен с ло-кусом на 5q, показал, что такая модель существенно лучше описывает наследование высокого базаль-ного уровня IgE. Недавно группой D.G.Marsh было показано существование региона на хромосоме 12ql5-q24.1, с которым ассоциирован базальный уровень IgE и астма в семьях некоторых малых этнических групп [12].
Предрасположенность к бронхиальной астме прослежена при прямых и при статистических исследованиях. В ряде случаев прослеживается определенная наследственная предрасположенность не только к наличию бронхиальной астмы, но и к определенной тяжести ее течения, а также к причинной роли отдельных неаллергических триггеров, таких как инфекция, физическая нагрузка и др.
Несмотря на то, что во многих случаях при ато-пии существует эволюция клинических ее проявлений, имеется семейная предрасположенность к респираторным проявлениям аллергии. В семьях больных частота заболевания астмой более высокая, чем частота обнаружения повышенного уровня общего IgE. Вместе с тем риск возникновения астмы находится в положительной корреляции с повышенным уровнем IgE (log) и в отрицательной корреляции с низким базальным уровнем IgE [21].
 Измененная бронхиальная реактивность может существовать до первого эпизода бронхиальной обструкции, связанной с инфекционным (вирусным) бронхиолитом, и. таким образом, вирусная инфекция может играть роль не причины бронхиальной гиперреактивности, а фильтра, отбирающего предрасположенных индивидуумов.
Измененная бронхиальная реактивность может существовать до первого эпизода бронхиальной обструкции, связанной с инфекционным (вирусным) бронхиолитом, и. таким образом, вирусная инфекция может играть роль не причины бронхиальной гиперреактивности, а фильтра, отбирающего предрасположенных индивидуумов.
Бронхиальная гиперреактивность (БГР) также выявляет связь с генетическими маркерами сегмента 5q31.1-q33 хромосомы 5, что указывает на сочетанное наследование предрасположенности к повышенному уровню IgE и предрасположенности к БГР и астме, а ген, ответственный за БГР, локализован вблизи главного локуса регуляции общего
уровня IgE. Здесь уместно упомянуть, что на достаточно ограниченном участке, распространяющемся в 5q31.1-q33, кроме упомянутого выше кластера генов IL-4, расположены гены IL-9 (IL-9 является цитокином, активирующим тучные клетки) и ADRB2 (ген. кодирующий β,-адренорецептор), связь которых с астмой предстоит оценить. Единичные исследования указывают на наличие ал-лельной ассоциации между полиморфными маркерами гена IL-9 и log IgE (но не БГР) и на генетический полиморфизм β,-адренорецептора, ассоциированный с наличием (Glylo) или отсутствием (Argl6) ночной астмы [23, 24, 25].
Еще одним претендентом на роль основного гена предрасположенности к атопии и астме является ген, кодирующий β-цепь высокоафинного Ее рецептора IgE, ΓΐεΚΙβ, картированный в 1 Iql3 [23, 24]. Было показано, что мутация изолейцина на лейцин в позиции 181 (IltlSILeu) в трансмембранном домене β-цепи встречается в 17% английских семей с атопическим фенотипом, однако эта находка не подтверждена в некоторых других регионах (Италия, Япония). В другом исследовании генетических маркеров хромосомы 1 lq было показано, что аллель 168 локуса Dl 1S527 достоверно ассоциирована с БГР, но не связана с log IgE, тогда как в другом локусе D11S534 аллель 235 достоверно ассоциирована с log IgE, но не с феноменом БГР. Оба указанных маркера локализованы вне гена, кодирующего РсеКф.
Всегда ли аллергическое воспаление необходимо для возникновения бронхиальной астмы? По-видимому, нет. На это указывает известный факт неаллергических вариантов бронхиальной астмы («эндогенной астмы», по определению Rackemann): рецидивирующих приступов удушья при отсутствии их связи с провокацией аллергенами, отрицательным аллергологическим анамнезом, негативными результатами кожного тестирования или определения IgE (IgG) антител in vitro, низким общим уровнем IgE. Базальный уровень IgE ассоциирован с возникновением астмы независимо от клинических проявлений атопии, т. е. молекула IgE может каким-то образом осуществлять роль медиатора бронхиальной гиперреактивности. Несколько месяцев назад было показано, что трансплантация стволовой клетки от линейных мышей с врожденной бронхиальной гиперреактивностью приводила к появлению этого свойства у здоровых мышей-реципиентов. Перенос признака осуществлялся и в безантигенных условиях. В этих случаях БГР возникала без признаков воспалительных изменений в бронхиальной стенке [15, 17]. Случаи переноса бронхиальной астмы описаны после трансплантации костного мозга у людей [11]. Эти эксперименты и клинические наблюдения указывают на наличие эндогенного генетического механизма, регулирующего бронхиальную реактивность и опосредованного связанными с лимфоцитами неизвестными регулирующими факторами, отличными от упомянутого «классического» Th2-IgE механизма.
Таким образом, генетическая основа бронхиальной астмы является комбинацией полностью независимых (с генетической точки зрения) или слабо связанных главных патогенетических составляющих болезни: предрасположенности к атопии и Th2-IgE опосредованному воспалению, к продукции специфических антител класса IgE и к бронхиальной гиперреактивности.
Очевидно, основные гены предрасположенности содержатся в хромосомах 5 и 11, причем особую роль играет кластер генов цитокинов в 5q31.1-33· Кроме того, существуют другие нерасшифрованные к настоящему времени механизмы, важную роль которых можно предположить при неаллергических вариантах заболевания. Независимость с генетической точки зрения переплетает указанные компоненты на уровне патогенетической реализации. Каждый из генетических факторов предрасположенности повышает вероятность заболевания астмой, а их комбинация приводит к высокому риску развития заболевания, требующего минимального участия факторов внешней среды.
Основными обобщающими положениями генетических механизмов развития бронхиальной астмы являются следующие:
Дата добавления: 2020-03-17; просмотров: 834;











