Процессинг и-РНК у эукариот
Все стадии процессинга и-РНК происходят в РНП-частицах (рибонуклеопротеидных комплексах).
По мере синтеза про-и-РНК, она тут же образует комплексы с ядерными белками – информоферами. И в ядерные, и в цитоплазматические комплексы и-РНК с белками (информосомы) входят s-РНК (малые РНК).
Таким образом, и-РНК не бывает свободной от белков, поэтому на всем пути следования до завершения трансляции и-РНК защищена от нуклеаз. Кроме того, белки придают ей необходимую конформацию.
Пока вновь синтезированная про-и-РНК (первичный транскрипт или гя-РНК – гетерогенная ядерная РНК) еще находится в ядре, она подвергается процессингу и превращается в зрелую и-РНК, прежде чем начать функционировать в цитоплазме. Гетерогенная ядерная РНК копирует всю нуклеотидную последовательность ДНК от промотора до терминатора, включая нетранслируемые области. После этого гя-РНК претерпевает преобразования, которые обеспечивают созревание функционирующей матрицы для синтеза полипептидной цепочки. Обычно гя-РНК в несколько раз (иногда в десятки раз) больше зрелой и-РНК. Если гя-РНК составляет примерно 10 % генома, то зрелая и-РНК – только 1-2 %.
В ходе ряда последовательных стадий процессинга из про-и-РНК (транскрипта) удаляются некоторые фрагменты, ненужные в последующих стадиях, и происходит редактирование нуклеотидных последовательностей.
► При кэпировании происходит присоединение к 5'-концу транскрипта 7-метилгуанозина посредстом трифосфатного моста, соединяющего их в необычной позиции 5'-5', а также метилирование рибоз двух первых нуклеотидов. Процесс кэпирования начинается еще до окончания транскрипции молекулы про-и-РНК. По мере образования про-и-РНК (еще до 30-ого нуклеотида), к 5'-концу, несущему пуринтрифосфат, присоединяется гуанин, после чего происходит метилирование.
Функции кэп-группы:
ü регулирование экспорта и-РНК из ядра;
ü защита 5'-конца транскрипта от экзонуклеаз;
ü участие в инициации трансляции: узнавание молекулы и-РНК малыми субъединицами рибосомы и правильная установка и-РНК на рибосоме.
► Полиаденилирование заключается в присоединении к 3'-концу транскрипта остатков адениловой кислоты, который осуществляет специальный фермент poly(A)-полимераза.
Когда синтез про-и-РНК завершен, то на расстоянии примерно 20 нуклеотидов в направлении к 3'-концу от последовательности 5'-AAУAA-3' происходит разрезание специфической эндонуклеазой и к новому 3'-концу присоединяется от 30 до 300 остатков АМФ (безматричный синтез).
► Сплайсинг[англ. “splice” – соединять, сращивать]. После полиаденилирования про-и-РНК подвергается удалению интронов. Процесс катализируется сплайсосомами и называется сплайсингом. В 1978 г. Филипп Шарп (Массачусетский технологический институт) открыл явление сплайсинга РНК.
Сплайсинг показан для большинства и-РНК и некоторых т-РНК. У простейших найден автосплайсинг р-РНК. Сплайсинг показан даже для археобактерий.
Не существует единого механизма сплайсинга. Описано по крайней мере 5 разных механизмов: в ряде случаев сплайсинг осуществляют ферменты-матюразы, в некоторых случаях в процессе сплайсинга участвуют s-РНК. В случае автосплайсинга процесс происходит благодаря третичной структуре про-р-РНК.
Для и-РНК высших организмов существуют обязательные правила сплайсинга:
 Правило 1. 5' и 3' концы интрона очень консервативны: 5'(ГT-интрон-AГ)3' .
Правило 1. 5' и 3' концы интрона очень консервативны: 5'(ГT-интрон-AГ)3' .
 Правило 2. При сшивании копий экзонов соблюдается порядок их расположения в гене, но некоторые из них могут быть выброшены.
Правило 2. При сшивании копий экзонов соблюдается порядок их расположения в гене, но некоторые из них могут быть выброшены.
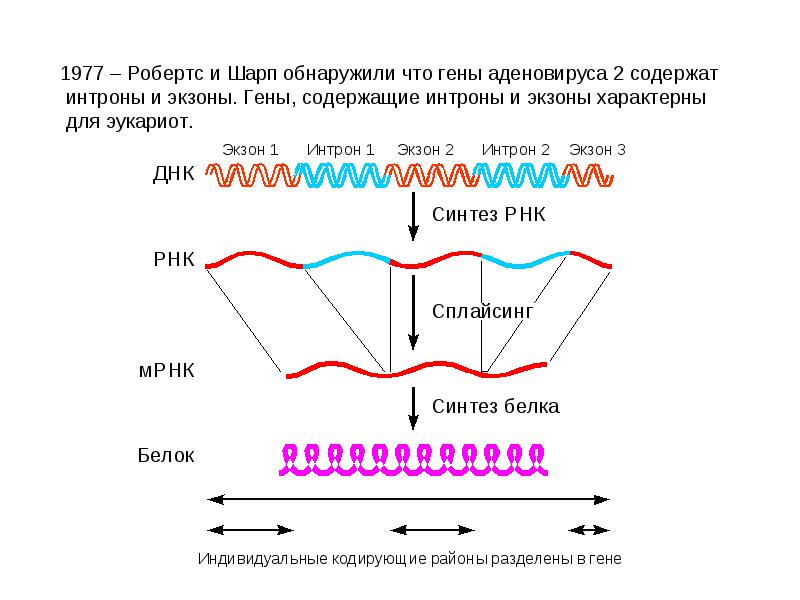
Точность сплайсинга регулируют s-PНК: малые ядерные РНК (мя-РНК), которые имеют участки, комплементарные концам интронов. мя-РНК комплементарна нуклеотидам на концах интронов – она временно соединяется с ними, стягивая интрон в петлю. Концы кодирующих фрагментов соединяются, после чего интрон благополучно удаляется из цепи.
③ ТРАНСЛЯЦИЯ [от лат. “translatio” – передача] заключается в синтезе полипептидной цепи в соответствии с информацией, закодированной в и-РНК. Молекула и-РНК (после процессинга у эукариот и без процессинга у прокариот) участвует в другом матричном процессе – трансляции (синтезе полипептида), который протекает на рибосомах (рис. 58).
Рибосомы – немембранные самые мелкие клеточные органоиды, при этом они едва ли не самые сложные. В клетке Е. coli присутствует около 103 – 5x103 рибосом. Линейные размеры прокариотической рибосомы 210 х 290Å. У эукариот – 220 х 320Å.
Выделяют четыре класса рибосом:
1. Прокариотические 70S.
2. Эукариотические 80S.
3. Рибосомы митохондрий (55S – у животных, 75S – у грибов).
4. Рибосомы хлоропластов (70S у высших растений).
S – коэффициент седиментации или константа Сведберга. Отражает скорость осаждения молекул или их компонентов при центрифугировании, зависящую от конформации и молекулярного веса.
Каждая рибосома состоит из 2-х субъединиц (большой и малой).
Сложность объясняется тем, что все элементы рибосом представлены в одном экземпляре, за исключением одного белка, присутствующего в 4 копиях в 50S субъединице, и не могут быть заменены.
р-РНК выполняют не только функцию каркасов субъединиц рибосом, но и принимают непосредственное участие в синтезе полипептидов.
23S р-РНК входит в каталитический пептидилтрансферазный центр, 16S р-РНК необходима для установки на 30S субъединице инициирующего кодона и-PHK, 5S р-РНК – для правильной ориентации аминоацил-тPHK на рибосоме.
Все р-РНК обладают развитой вторичной структурой: около 70% нуклеотидов собрано в шпильки.
р-РНК в значительной степени метилированы (СН3-группа во втором положении рибозы, а также в азотистых основаниях).
Порядок сборки субъединиц из р-РНК и белков строго определен. Субъединицы, не соединенные друг с другом, представляют собой диссоциированные рибосомы. Соединенные – ассоциированные рибосомы. Для ассоциации нужны не только конформационные изменения, но и ионы магния Mg2+ (до 2x103 ионов на рибосому). Магний нужен для компенсации отрицательного заряда р-РНК. Все реакции матричного синтеза (репликация, транскрипция и трансляция) связаны с ионами магния Mg2+ (в меньшей степени – марганца Мn2+).
Молекулы т-РНК представляют собой относительно небольшие нуклеотидные последовательности (75-95 нуклеотидов), комплементарно соединённые в определённых участках. В результате формируется структура, напоминающая по форме лист клевера, в которой выделяют две наиболее важные зоны – акцепторная часть и антикодон.
Акцепторная часть т-РНК состоит из комплементарно соединённых 7 пар оснований и несколько более длинного одиночного участка, заканчивающегося 3′-концом, к которому присоединяется транспортируемая соответствующая аминокислота.
Другой важный участок т-РНК – антикодон, состоящий из трёх нуклеотидов. Этим антикодоном т-РНК по принципу комплементарности определяет себе место на и-РНК, определяя тем самым очерёдность присоединения транспортируемой им аминокислоты в полипептидную цепочку.
Наряду с функцией точного узнавания определённого кодона в и-РНК молекула т-РНК связывается и доставляет к месту синтеза белка определённую аминокислоту, присоединённую ферментом аминоацил-тРНК-синтетазы. Этот фермент обладает способностью к пространственному узнаванию, с одной стороны, антикодона т-РНК и, с другой, – соответствующей аминокислоты. Для транспортировки 20 типов аминокислот используются свои транспортные РНК.
Процесс взаимодействия и-РНК и т-РНК, обеспечивающий трансляцию информации с языка нуклеотидов на язык аминокислот, осуществляется на рибосомах.
Рибосомы представляют собой сложные комплексы рибосомной РНК (р-РНК) и разнообразных белков. Рибосомная РНК является не только структурным компонентом рибосом, но и обеспечивает связывание её с определённой нуклеотидной последовательностью и-РНК, устанавливая начало и рамку считывания при образовании пептидной цепи. Кроме того, они обеспечивают взаимодействие рибосомы с т-РНК.
В рибосомах имеются две зоны. Одна из них удерживает растущую полипептидную цепь, другая – и-РНК. Кроме того, в рибосомах выделяют два участка, связывающих т-РНК. В аминоацильном участке размещается аминоацил-т-РНК, несущая определённую аминокислоту. В пептидильном находится т-РНК, которая освобождается от своей аминокислоты и покидает рибосому при её перемещении на один кодон и-РНК.
В процессе трансляции выделяют следующие стадии:
1. Стадия активации аминокислот. Активация свободных аминокислот осуществляется при помощи особых ферментов (аминоацил-тРНК-синтетаз) в присутствии АТФ. Для каждой аминокислоты существует свой фермент и своя т-РНК.
Активированная аминокислота присоединяется к своей т-РНК с образованием комплекса аминоацил-т-РНК (аа-т-РНК). Только активированные аминокислоты способны образовывать пептидные связи и формировать полипептидные цепочки.
2. Инициация. Начинается с присоединения лидирующего 5'-конца и-РНК с малой субъединицей диссоциированной рибосомы. Соединение происходит так, что стартовый кодон (всегда АУГ) оказывается в «недостроенном» Р-участке. Комплекс аа-т-РНК с помощью антикодона т-РНК (УАЦ) присоединяется к стартовому кодону и-РНК. Имеются многочисленные (особенно у эукариот) белки – факторы инициации.
У прокариот стартовый кодон кодирует N-формилметионж, а у эукариот – N-метионин. В дальнейшем эти аминокислоты вырезаются ферментами и не входят в состав белка. После образования инициирующего комплекса происходит объединение субъединиц и «достраивание» Р- и А-участков (рис.60).
3. Элонгация. Начинается с присоединения в А-участок и-РНК второго комплекса аа-т-РНК с антикодоном, комплементарным следующему кодону и-РНК. В рибосоме оказываются две аминокислоты, между которыми возникает пептидная связь. Первая т-РНК освобождается от аминокислоты и покидает рибосому. Рибосома перемещается вдоль нити и-РНК на один триплет (в направлении 5'→3'). 2-я аа-т-РНК перемещается в Р-участок, освобождая А-участок, который занимает следующая 3-я аа-т-РНК. Таким же образом присоединяются 4-я, 5-я и т. д. аминокислоты, принесенные своими т-РНК.
4. Терминация. Завершение синтеза полипептидной цепочки. Наступает тогда, когда рибосома дойдет до одного из терминирующих кодонов. Имеются особые белки (факторы терминации), которые узнают эти участки.
На одной молекуле и-РНК может располагаться несколько рибосом (такое образование называется полисома), что позволяет осуществлять синтез нескольких полипептидных цепей одновременно
Процесс биосинтеза белка проходит с участием большего количества специфических биохимических взаимодействий. Он представляет собой фундаментальный процесс природы. Несмотря на чрезвычайную сложность (особенно в клетках эукариот), синтез одной молекулы белка длится всего 3-4 секунды.
Аминокислотная последовательность выстраивается при помощи транспортных РНК (т-РНК), которые образуют с аминокислотами комплексы — аминоацил-тРНК. Каждой аминокислоте соответствует своя т-РНК, имеющая соответствующий антикодон, «подходящий» к кодону и-РНК. Во время трансляции рибосома движется вдоль и-РНК, по мере этого наращивается полипептидная цепь. Биосинтез белка обеспечивается за счет энергии АТФ.
Готовая белковая молекула затем отщепляется от рибосомы и транспортируется в нужное место клетки, но для достижения своего активного состояния белкам требуется дополнительная посттрансляционная модификация.
Биосинтез белка происходит в два этапа. В первый этап входит транскрипция и процессинг РНК, второй этап включаеттрансляцию. Во время транскрипции фермент РНК-полимераза синтезирует молекулу РНК, комплементарную последовательности соответствующего гена (участка ДНК). Терминатор в последовательности нуклеотидов ДНК определяет, в какой момент транскрипция прекратится. В ходе ряда последовательных стадий процессинга из мРНК удаляются некоторые фрагменты, и редко происходит редактирование нуклеотидных последовательностей. После синтеза РНК на матрице ДНК происходит транспортировка молекул РНК в цитоплазму. В процессе трансляции информация, записанная в последовательности нуклеотидов, переводится в последовательность остатков аминокислот.
19.ДНК. Строение, свойства, кодовая система.
Дата добавления: 2016-06-18; просмотров: 8328;











