ТЕМА 5. ФИЗИКО – ХИМИЧЕСКИЕ ОСНОВЫ УДАЛЕНИЯ ВЗВЕШЕННЫХ И КОЛЛОИДНЫХ ПРИМЕСЕЙ
1. Поглощение поверхностью вещества газов, паров и растворенных веществ это:
а) адсорбция;
б) флотация;
в) коагуляция.
2. Вещество адсорбирующее на своей поверхности другое вещество называется:
а) адсорбатом;
б) адсорбентом;
в) адсорбтивом.
3. Указать правильное утверждение:
а) адсорбция и абсорбция описывают один и тот же процесс;
б) адсорбат – адсорбент, насыщенный адсорбтивом при данных условиях;
в) хемосорбция – это процесс поглощения адсорбтива всей массой адсорбента.
4. Адсорбция – это:
а) процесс поглощения адсорбтива всей массой поглотителя;
б) химическое взаимодействие вещества с поглотителем;
в) поглощение вещества поверхностью адсорбента.
5. От каких факторов зависит адсорбция газов твердыми поглотителями:
а) от общего объема поглотителя;
б) от общей массы поглотителя;
в) суммарной поверхности твердого тела.
6. Количество вещества адсорбированного 1см2 поверхности адсорбента зависит от:
а) состояния поверхности адсорбента;
б) от давления в системе;
в) от массы адсорбента и адсорбтива.
7. Применение адсорбции:
а) удаление тяжелых металлов из сточных вод химическими методами;
б) очистка газов и растворов от примесей;
в) обеззараживание воды.
8. К какому типу дисперсных систем относятся системы с размером частиц вещества от 1 до 100нм:
а) коллоидные системы;
б) грубодисперсные системы;
в) истинные растворы.
9. От чего зависит величина свободной межфазной энергии?
а) удельной поверхности частиц;
б) агрегатного состояния дисперсионной среды;
в) от агрегатного состояния дисперсной фазы.
10. Что является критерием при отнесении коллоида к классу аэрозолей?
а) агрегатного состояния дисперсионной среды;
б) от агрегатного состояния дисперсной фазы;
в) межфазное взаимодействие дисперсной фазы и дисперсионной среды.
11. Какие классы коллоидных систем выделяются по межфазному взаимодействию среды и фазы?
а) лиофильные и лиофобные;
б) лиозоли, солиозоли;
в) суспензоиды и мицелярные коллоиды.
12. Суспензоиды – это:
а) защитные коллоиды;
б) высокодисперсные гетерогенные системы;
в) молекулярные коллоиды.
13. Указать выражение степени дисперности (D):
а) D = L
б) D = 1/L
в) D = S/ V
14. Из чего состоят дифильные молекулы?
а) углеводородного радикала и полярной группы;
б) полярной группы и подвижного аниона;
в) углеводородного радикала и остатка кислоты.
15. В каких случаях применяют электродиспергирование, как способ получения коллоидного раствора.
а) для получения фенолформальдегидных смол;
б) для получения аэрозолей;
в) для получения золей металлов.
16. По каким признакам можно отличить золь от взвеси?
а) седиментационное равновесие;
б) эффект Тиндаля;
в) броуновское движение.
17. Отличие коллоидных систем от истинных растовров:
а) эффект Тиндаля;
б) свойства растворителя;
в) свойства растворенного вещества.
18. Для золя гидроксида железа II потенциалообразующим ионом будет FeOCl. Указать заряд мицеллы золя и ионы образующие диффузионный слой:
а) заряд (+), Cl- ;
б) заряд (-), FeO+;
в) заряд (+); FeO+.
19. Для золя гидроксида железа II потенциалообразующим ионом будет FeOCl. Указать заряд мицеллы и ионы образующие адсорбционной и потенциалопределяющий слой:
а) заряд (+), Cl- , FeO+;
б) заряд (-), FeO+, Cl-;
в) заряд (0), Cl-, Cl-.
20. Электрокинетический потенциал - это:
а) разность потенциалов на границе потенциалопределяющего и адсорбционного слоев мицеллы золя;
б) разность потенциалов между подвижным и неподвижным слоями мицеллы золя;
в) разность потенциалов между ядром мицеллы и диффузионным слоем мицеллы.
21. Указать правильное утверждение:
а) коагуляция электролитами наступает в результате увеличения электрокинетического потенциала;
б) коагуляция электролитами наступает в результате сжатия диффузного слоя мицелл;
в) коагуляция электролитами наступает в результате расширения потенциалопределяющего слоя мицеллы.
22. Коагуляция – это;
а) разрушение коллоида под влиянием различных факторов;
б) образование коллоида при практически полной нерастворимости вещества в растворителе;
в) образование молекулярного коллоида при большом скоплении дифильных молекул.
23. Электролит, вызывающий коагуляцию, называется:
а) коагулятором;
б) коагулянтом;
в) флокулянтом.
24. Седиментация – это:
а) флокуляция и образование хлопьев;
б) разрушение мицелл;
в) осаждение частиц под действием силы тяжести.
25. Процесс обратный коагуляции:
а) седиментация;
б) флокуляция;
в) пептизация.
26. Определение оптимальной дозы коагулянта определяется:
а) экспериментально;
б) математически;
в) по формулам.
27. Коагулянты – это:
а) соли слабых кислот и сильных оснований;
б) соли сильных кислот и слабых оснований;
в) соли слабых оснований и слабых кислот.
28. Укажите безреагентные методы коагуляции:
а) электрокоагуляция, электрофорез;
б) электрокоагуляция, флотация, гиперфильтрация;
в) электрофорез, метод ионного обмена, флотация.
29. Какой электролит предпочтительней для коагуляции золя АУ (электроотрицательного):
а) FeSO4;
б) Al2(SO4)3;
в) NaCl.
30. Указать ион коагулятор для золя AgI (электроположительного):
а) SO42-;
б) [Fe(CN)6]3-;
в) PO43-/
31. Какой электролит эффективнее в случае коагуляции сульфида мышьяка (электроположительного):
а) NaCl;
б) Na3PO4;
в) AlCl3.
32. Подобрать лучший коагулянт для коллоида Fe(OH)3 (электропололжительного):
а) NaCl;
б) Al2(SO4)3;
в) K3[Fe(CN)6].
33. Для золя сульфида цинка (электроотрицательного) подобрать коагулянт:
а) FeSO4;
б) Fe2(SO4)3;
в) NaCl.
34. Сульфат бария получен сливанием одинаковых объемов сильно разбавленного раствора BaCl2 и менее разбавленного раствора серной кислоты. Подобрать наиболее эффективный коагулянт:
а) FeSO4;
б) Fe2(SO4)3;
в) NaCl.
35. Золь иодида серебра получен приливанием избытка нитрата серебра к раствору иодида калия. К какому электроду будут двигаться мицеллы золя при электрофорезе. Указать ионы коагуляторы: NaCl, Al2SO4, FeCl2.
а) к отрицательному: Cl-, SO42-;
б) к отрицательному: Na+, Al3+, Fe2+;
в) к положительному:Cl-, SO42-.
36. Укажите формулу мицеллы золя бромида серебра, полученного при взаимодействии раствора нитрата серебра с избытком бромида натрия. Какой заряд будет иметь гранула?
а) {[(AgBr ∙ n)Br- ∙ m]Na+(m-x)}Na ∙ x; заряд (-);
б) {[(AgNO3 ∙ n)Ag+∙ m]Na+(m-x)}Na ∙ x; заряд (+);
в) {[(NaBr ∙ n)Br2- ∙ m]NO3-(m-x)}NO3 ∙ x; заряд (-).
37. В каких случаях нельзя применять метод коагуляции при водоподготовке?
а) при осветлении и обесцвечивании воды;
б) при удалении взвешенных веществ;
в) при умягчении и обеззараживании воды.
38. Указать правильное утверждение:
а) флокулянты – это высокомолекулярные соединения, способствующие укрупнению агрегатов разрушающегося коллоида;
б) флокулянты – это защитные коллоиды, высокомолекулярные соединения, предотвращающие коллоид от расслаивания;
в) флокулянты – это высокомолекулярные соединения относящиеся к суспензоидам.
39. Указать этапы коагуляции:
а) коагуляция электролитами, физико-химическая коагуляция, седиментация;
б) скрытая коагуляция, пептизация, флокуляция;
в) скрытая коагуляция, флокуляция, седиментация.
40. Указать правильное утверждение:
а) электрокинетический потенциал – мера устойчивости коллоидной системы;
б) увеличение электрокинетического потенциала вызывает коагуляцию золя;
в) состояние золя при котором электрокинетический потенциал максимален, называется изоэлектрической точкой.
ИТОГОВЫЕ ТЕСТЫ
1. Почему молекулы воды могут взаимодействовать друг с другом?
а) т.к. молекулы воды имеют дипольные моменты;
б) т.к. в воде наблюдаются аномами плотности;
в) т.к. у воды высокая диэлектрическая проницаемость.
2. Дисперсная система с размерами частиц дисперсной фазы более 100 нм это:
а) коллоидный раствор;
б) грубодисперсная система;
в) истинный раствор.
3. Указать правильное утверждение:
а) при увеличении температуры растворимость кристаллических тел уменьшается;
б) температура не влияет на растворимость кристаллических тел;
в) при увеличении температуры растворимость кристаллических тел увеличивается.
4. Насыщенный раствор это:
а) раствор, находящийся в динамическом равновесии с избытком растворимого вещества;
б) раствор с высокой концентрацией растворимого вещества;
в) раствор в котором избыточное вещество выкристаллизовывается при встряхивании или внесении в раствор центров кристаллизации.
5. Молярность выражается:
а) числом молей вещества в 1 литре растворителя;
б) числом молей в 1 литре раствора;
в) числом молей в 1 кг (1000 г) растворителя.
6. Что является причиной того, что морские бактерии и рыбы не могут жить в пресной воде:
а) явление осмоса;
б) органические свойства воды;
в) физические свойства воды.
7. Для реакции А + В ↔ С + Д 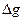 > 0 ; в каком направлении будет протекать реакция:
> 0 ; в каком направлении будет протекать реакция:
а) в прямом;
б) в обратном;
в) устанавливается термодинамическое равновесие.
8. Указать выражение константы диссоциации для процесса диссоциации, протекающий по уравнению СН3СООН ↔ СН3СОО- + Н+:
а) 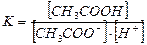 ;
;
б) 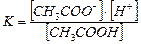 ;
;
в) 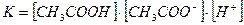 .
.
9. Указать выражение для ионного произведения воды (КВ):
а) 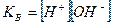 ;
;
б) 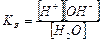 ;
;
в) 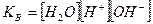 .
.
10. Определить величину рН если [OH-] = 1 ∙ 10-2 моль/л:
а) 1 ∙ 1014;
б) 12;
в) 2.
11. Для выражения общей кислотности служит:
а) водородный показатель (рН);
б) нормальность раствора;
в) молярность раствора.
12. Указать буферные растворы:
а) CH3COOH и H2CO3;
б) NH4OH и NaOH;
в) NH4OH и NH4Cl.
13. Указать реакцию среды раствора ZnCl2:
а) щелочная;
б) слабокислая;
в) кислая.
14. Для золя сульфата бария, полученного сливанием одинаковых объемов сильноразбавленного раствора хлорида бария и концентрированной серной кислоты потенциалобразующим ионом будет:
а) 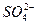 ;
;
б) Ba2+;
в) Cl-.
15. Мерой устойчивости коллоидной системы является:
а) электрохимический потенциал;
б) термодинамический потенциал;
в) двойной электрический слой.
16. Процесс обратный коагуляции:
а) пептизация;
б) диссоциация;
в) седиментация.
17. Для электроположительного золя AgJ наиболее эффективными ионами коагуляторами будут:
а) SO 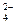 ;
;
б) Al3+;
в) Сl-.
18. Метод определения мутности воды:
а) нефелометрия;
б) титрование;
в) рН – метрия.
19. На величину ХПК оказывают влияние:
а) CH3COOH и С6Н6;
б) С2Н5ОН и NaNO3;
в) H2SO4 и NaCl.
20. Назвать флокулянт:
а) Полиакриламид;
б) сульфат алюминия;
в) фенолформальдегидные смолы.
21. Веществами, обладающими бактерицидными свойствами является:
а) NaCl, NaOCl;
б) NaOCl, СlO2;
в) СaCl2O, HCl.
22. Для устранения хлорфенольных запахов применяется:
а) хлор-медный метод;
б) хлорирование с аммонизацией;
в) дехлорирование.
23. Олигодинамия это:
а) обеззараживание воды ионами серебра;
б) обработка воды ультрафиолетовыми лучами;
в) обеззараживание воды физическими методами.
24. Временная жесткость обуславливается солями:
а) СаСО3, CaCl2;
б) Сa(HCO3)2, Mg(HCO3)2;
в) MgCO3, CaSO4.
25. Какой процесс лежит в основе умягчения воды:
а) образование нерастворимых соединений кальция и магния;
б) образование газообразных продуктов;
в) коагуляция.
26. Какие соединения образуются при добавлении в воду Cа(ОН)2:
а) СаСО3, MgCO3;
б) СаО, MgO;
в) Mg(OH)2, Ca(HCO3)2.
27. Указать схему, соответствующую умягчению воды методом ионного обмена:
а) R – H + Ca2+ = R2Ca + H+;
б) Mg(HCO3)2 + Ca(OH)2 = Mg(OH)2 + Ca(HCO3)2;
в) R – OH + Сl- = R – Cl + OH-.
28. Бактерии, способные развиваться в бескислородной среде:
а) аэробы;
б) анаэробы;
в) прокариоты;
29. Условно-патогенный организм:
а) кишечная палочка;
б) инфузория;
в) коловратка.
30. Бактерии, использующие углерод неорганических соединений:
а) автотрофы;
б) гетеротрофы;
в) сапрофиты.
31. Указать правильное утверждение:
а) ХПК это часть БПК;
б) БПК это часть ХПК;
в) ХПК и БПК равны между собой.
32. На величину БПК оказывают влияние:
а) H2SO4, NaCl;
б) СН3СООН, NaCl;
в) С2Н5ОН, СН3СООН.
33. Из общей массы гидросферы доля пресных вод составляет:
а) до 1%;
б) от 2% до 5%;
в) от 20%.
34. К главным ионам, доля которых в любых природных поверхностных водах превышает 95% от общей массы катионов или анионов, относятся следующие группы анионов и катионов (выберите правильный набор):
а) Na+, K+, Ca2+, Mg2+, Fe3+;
б) Na+, K+, Fe3+, SiO 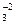 ;
;
в) Na+, K+, Ca2+, Fe3+.
35. Как правильно называются морские воды в соответствии с классификацией природных вод:
а) сульфатно-кальциевые, 3-й группы;
б) сульфатно-натриевые, 3-й группы;
в) хлоридно- натриевые, 3-й группы.
36. Значение щелочности природных вод определяется суммой концентраций ионов:
а) СО 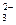 и SO
и SO 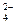 ;
;
б) HCO 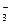 , ОН- и удвоенной концентрации СО
, ОН- и удвоенной концентрации СО 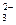 ;
;
в) HCO 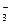 , ОН- и удвоенной концентрации ОН-.
, ОН- и удвоенной концентрации ОН-.
37. Каким может быть содержание растворенного кислорода у дна глубоко озера на территории с умеренным климатом в конце периода стратификации?
а) равно нулю;
б) больше чем у поверхности;
в) составляет 50-70% от насыщения.
38. Каково содержание растворенного кислорода у дна океана в любое время года:
а) составляет 50-70% от значений, являющихся равновесными для соответствующих условий;
б) в полтора раза выше чем у поверхности;
в) равно нулю.
39. Какое из утверждений правильно характеризует грунтовые воды?
а) грунтовыми называются подземные воды, расположенные на первом от поверхности земли водоупорном слое, имеющим значительную площадь распространения;
б) основную опасность для загрязнения грунтовых вод соединениями тяжелых металлов представляют выбросы автотранспорта;
в) грунтовые воды лежат в зоне аэрации и лежат между двумя водоупорными слоями.
40. Выберите правильный набор катионов, определяющих жесткость природной воды:
а) Na+, K+, Ca2+;
б) Fe2+, Ca2+, Na+;
в) Сa2+, Mg2+.
41. Каково значение щелочности Мирового океана:
а) 2,29 ∙ 10-3 моль/л;
б) 140 м2/л;
в) 2,29 моль/л.
42. Эвторификация водоемов приводит:
а) к улучшению гомеостаза экосистемы;
б) к росту биомассы синезеленых водорослей, приводящему к уменьшению концентрации кислорода.
в) к уменьшению количества растворенного кислорода в результате связывания его с молекулами загрязняющих веществ.
43. Какие природные источники поступления главных ионов в подземные воды Вы знаете:
а) хозяйственная деятельность человека;
б) растворение минералов и грунтов залегания;
в) атмосферные осадки.
44. Биологическая очистка основана на том что:
а) мелкораздробленная взвесь, коллоидные и растворенные вещества разрушаются в процессе жизнедеятельности аэробных микроорганизмов;
б) микроорганизмы воды уничтожаются бактерицидными веществами;
в) бактериальные формы удаляются с помощью процесса химической коагуляции.
45. Назвать гетеротрофные микроорганизмы:
а) хламидомонада;
б) спирогира;
в) амеба обыкновенная.
46. Естественная кислотность обусловлена:
а) содержанием слабых органических кислот природного происхождения (например, гуминовых);
б) содержанием серной и соляной кислот;
в) содержанием летучих оснований.
47. Типы химического состава воды определяет:
а) концентрации органических веществ;
б) соотношение концентраций в воде главных ионов (мг∙экв/л);
в) щелочность и кислотность воды.
48. На чем основан метод определения массовой концентрации сульфат-анионов?
а) на реакции сульфат-анионов с катионами бария с образованием сульфита бария;
б) с раствором нитрата серебра (взаимодействие);
в) на взаимодействие с хроматом серебра.
49. Переход аммонийных соединений в нитриты обусловлен:
а) деятельностью нитратобразующих бактерий в аэробных условиях;
б) микробиологическим разложением белков животного происхождения;
в) микробным разложением белков растительного происхождения.
50. Определению соединений фтора в воде мешают:
а) соединения Са и Mg;
б) соединения Al, Fe и органических веществ;
в) сульфаты.
51. Тяжелые металлы по характеру биологического воздействия делятся на:
а) микроэлементы и биогенные элементы;
б) токсиканты и биогенные элементы;
в) токсиканты и микроэлементы.
52. Токсиканты представлены следующими соединениями:
а) кадмий, свинец, ртуть;
б) марганец, медь;
в) кобальт, марганец.
53. ПДК для фенолов в питьевой воде уменьшается с 0,1 до 0,001 мг/л в связи с образованием соединений при:
а) озонировании;
б) хлорировании;
в) фторировании.
54. Сумма приведенных концентраций рассчитывается:
а) для всех загрязняющих веществ;
б) отдельно для органических и неорганических веществ;
в) для веществ с одинаковым лимитирующим показателем вредности.
55. Классы качества воды определяют по:
а) индексу загрязненности воды;
б) содержанию тяжелых металлов;
в) степени минерализации.
56. Если содержание солей в воде 100 – 200 мг/л, то это воды:
а) ультрапресные;
б) повышенной минерализации;
в) маломинерализованные;
57. Растворимость в воде О2 возрастает:
а) с уменьшением t и минерализации и увеличения р;
б) с увеличением t и минерализации и уменьшения р;
в) с уменьшением t и увеличения минерализации и р.
58. Какие еще соли относятся к солям жесткости кроме солей Mg и Са:
а) Na+ и Cu2+;
б) Sr2+ и Zn2+;
в) Fe2+ и Fe3+.
59. Цветность воды обусловлена присутствием:
а) ионов Са и Mg;
б) сульфатов и хлоридов;
в) гуминовых соединений и комплексных соединений железа.
60. Какими свойствами молекул воды объясняется аномально высокая температура кипения воды:
а) изотопный состав воды;
б) полярность молекул воды;
в) диэлектрическая проницаемость воды.
61. Дисперсные системы с размером частиц дисперсной фазы менее 1 нм это:
а) коллоидные растворы;
б) истинные растворы;
в) Указать правильное утверждение:
62. Указать правильное утверждение:
а) при увеличении температуры растворимость газов увеличивается;
б) при увеличении температуры растворимость газообразных веществ уменьшается;
в) изменение температуру не влияет на растворимость веществ.
63. Растворимостью вещества называется:
а) количество граммов вещества, насыщающее 100 г растворителя при данных условиях;
б) число молей вещества в 100 мл насыщенного раствора;
в) количество граммов вещества насыщающее 1 л растворителя.
64. Эквивалентная концентрация выражается:
а) числом молей вещества, эквивалентных 100 г растворителя;
б) число эквивалентов вещества в 1 литре раствора;
в) число эквивалентов вещества в 1 литре растворителя;
65. Указать формулу для расчета моляльной концентрации (Сm):
а) Сm = mра-ля / 1000 ∙ Мв-ва;
б) Сm = mв-ва ∙ СМ ∙ Мв-ва;
в) Сm = 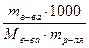 .
.
66. Указать правильное утверждение:
а) осмос это явление односторонней диффузии молекул растворителя через полупроницаемую мембран против градиента концентрации;
б) осмос это явление диффузии молекул растворенного вещества через полупроницаемую мембрану против градиента концентрации;
в) осмос это явление проникновения молекул вещества через полупроницаемую мембрану по градиенту концентрации.
67. Указать формулу для расчета осмотического давления:
а) 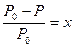 ;
;
б) р = СМRT;
в) р=kCм.
68. Возможно ли протекание процесса А + В = С, если 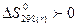 :
:
а) возможно;
б) невозможно;
в) в системе устанавливается состояние равновесия.
69. Указать правильное утверждение:
а) мольная доля компонента равна отношению числа молей этого компонента к сумме молей всех компонентов раствора;
б) мольная доля компонента это число моль данного компонента в 1 литре всего раствора;
в) мольная доля это отношение числа моль данного компонента к числу моль растворителя.
70. Указать формулу для расчета зависимости скорости реакции от температуры:
а) 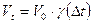 ;
;
б) 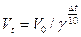 ;
;
в) 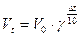 .
.
71. Какая из двух солей будет гидролизироваться сильнее Na2CO3 или Na2SO3?
а) Na2CO3;
б) Na2SO3;
в) гидролизу не подвергаются.
72. Какие соли не подвергаются гидролизу:
а) NaCl и NaNO3;
б) NaCl и Na2CO3;
в) NaNO3 и Na2SO3.
73. Определить рН раствора Na2SO3:
а) среда кислая, рН < 7;
б) среда щелочная, рН > 7;
в) среда кислая, рН > 7.
74. Определить рН раствора соли NaCN:
а) среда щелочная, рН < 7;
б) среда кислая, рН < 7;
в) среда щелочная, рН > 7.
75. Концентрация ионов водорода составляет 10-7 моль/л. Определить реакцию среды и указать величину рН:
а) среда щелочная, рН = 7;
б) среда нейтральная, рН = 7;
в) среда кислая, рН = 7 .
76. Концентрация ионов ОН- равна 1 ∙ 10-5. Определить реакцию среды:
а) рН = 5, среда кислая;
б) рН = 9, среда щелочная;
в) рН = 2, среда кислая.
77. От чего зависит степень гидролиза соли:
а) температуры, концентрации раствора и рН среды;
б) температуры, рН среды и давления;
в) концентрации раствора.
78. Определить число степеней свободы (С) для системы, состоящей из чистой воды в твердой фазе:
а) С = 1;
б) С = 2;
в) С = 3.
80. Определить число степеней свободы (С) в точке х, лежащей внутри жидкой фазы (Диаграмма состояния воды):
а) С = 1;
б) С = 2;
в) С = 3.
81. Разность потенциалов подвижного и неподвижного слоев это:
а) термодинамический потенциал;
б) двойной электрический слой;
в) электрокинетический потенциал.
82. Максимальная разность потенциалов в мицелле золя на границе твердое вещество – раствор называется:
а) электрокинетический потенциал;
б) дзета – потенциал;
в) термодинамический потенциал.
83. Цветность природных вод обусловлена присутствием:
а) жирных кислот;
б) оксидов металлов;
в) гуматами и фульватами железа.
84. Цветность воды выражается:
а) в градусах;
б) в мг/л;
в) в баллах.
85. Сухой остаток характеризует:
а) нелетучие примеси воды;
б) солесодержащие и количество коллоидно растворенных примесей;
в) солесодержание и летучие примеси воды.
86. Окисляемость воды характеризует:
а) общее содержание в воде восстановителей;
б) общее содержание в воде органических восстановителей;
в) общее содержание в воде неорганических восстановителей.
87. Общую окисляемость определяют:
а) иодатным методом;
б) аргентометрия;
в) комплексометрия.
88. Частичная окисляемость определяется по реакции с:
а) бихроматом калия;
б) перманганатом калия;
в) иодидом калия.
89. Какие показатели качества воды коррелируют между собой:
а) мутность и щелочность воды;
б) ХПК и хлоремкость воды;
в) ХПК и электропроводность воды.
90. В каком соединении активного хлора будет больше?
а) HCl;
б) НОCl;
в) NaCl.
91. Снижение концентрации кислорода растворенного в воде свидетельствует о:
а) загрязнении воды окислителями;
б) загрязнение воды;
в) загрязнении воды восстановителями.
92. БПК характеризует загрязненность воды:
а) органическими веществами;
б) микроорганизмами;
в) органическими окислителями.
93. Определение оптимальной дозы коагулянта осуществляется:
а) расчетным путем;
б) экспериментальным путем;
в) сравнением цветности воды со стандартной шкалой цветности.
94. Подобрать наиболее эффективный коагулянт для электроотрицательного золя:
а) Al2(SO4)3;
б) Na3PO4;
в) FeCl2.
95. Какой заряд будет иметь мицелла золя AgJ, полученного при реакции;
AgNO3 + KJ = AgJ↓ + KNO3
KJ – в избытке:
а) отрицательный;
б) положительный;
в) заряд отсутствует.
96. Изоэлектрическое состояние мицеллы золя наблюдается в случае если:
а) электрокинетический потенциал равен 0;
б) термодинамический потенциал = 0;
в) дзета потенциал максимальный.
97. Интенсификация процесса коагулирования достигается за счет:
а) понижение температуры;
б) добавления флокулянтов;
в) добавления электронов.
98. Осаждение агрегатов мицелл в процессе коагуляции это:
а) пептизации;
б) диссоциация;
в) седиментация.
99. Указать вещества применимые для обесцвечивания и осветления воды:
а) сульфат алюминия и серная кислота;
б) сульфат алюминия и активированная кремниевая кислота;
в) полиакриламид и сода.
100. Указать реакцию лежащую в основе обеззараживания воды хлором:
а) Cl2 + H2O ↔ HCl + HOCl;
б) Cl2 + SO2 + H2O ↔ HCl + H2SO4;
в) Cl2 + Na2S2O3 + H2O ↔ 2HCl + Na2SO4 + S.
101.Импфирование воды заключается в:
а) перевода некарбонатной жесткости в карбонатную;
б) перевода карбонатной жесткости в некарбонатную;
в) перевода общей жесткости во временную.
102. Указать реакцию, выражающую химическую сущность импфирования воды:
а) Ca(HCO3)2 ↔ CaCO3 ↓ + CO2 + H2O;
б) MgCO3 + H2O ↔ Mg(OH)2 + CO2;
в) Са(HCO3)2 + 2HCl ↔ CaCl2 + 2H2O + 2CO2.
103. Указать процесс, соответствующий обезжелезыванию воды:
а) 4FeSO4 + 4Ca(OH)2 + 2H2O + O2 ↔ 4CaSO4 + 4Fe(OH)3;
б) FeCl3 + H2O = Fe(OH)3 ↓ + HCl;
в) FeSO4 + Ca(OH)2 ↔ Fe(OH)2 + CaSO4.
104. Удаление кремниевой кислоты можно осуществить:
а) подщелачиванием воды;
б) подкислением воды;
в) дегазацией воды.
105. Обескислороживание воды осуществляется с применением:
а) перманганата калия;
б) гидразина;
в) гидроксиламина.
106. Спорообразующие палочковидные формы бактерий называются:
а) кокки;
б) спириллы;
в) бациллы.
107. К извитым бактериям относятся:
а) спириллы и кокки;
б) кокки и бациллы;
в) вибрионы и спириллы.
108. Аккумулятором энергии в клетках бактерий являются:
а) ДНК, белки и углеводы;
б) углеводы;
в) АТФ.
109. Указать процесс денитрификации:
а) 4KNO3 + 5C → 2K2CO3 + 3CO2 + 2N2;
б) 2NH3 + 3O2 → 2HNO2 + 2H2O;
в) 2HNO2 + O2 → 2HNO3.
110. По способу питания эвглена зеленая относится к:
а) автотрофам;
б) гетеротрофам;
в) в зависимости от условий может использовать оба способа.
111. Укажите правильное утверждение:
а) бактериальная клетка имеет ядро, цитоплазму и оболочку;
б) бактериальная клетка имеет ядро, митохондрии и рибосомы;
в) бактериальная клетка не имеет оформленного ядра.
112. Органами движения у бактерий являются:
а) жгутики и реснички;
б) псевдоподии и жгутики;
в) псевдоподии и реснички.
113. Брожение это:
а) анаэробное разложение органики;
б) аэробное разложение белков;
в) анаэробное окисление жирных кислот.
114. Гомогенные примеси в воде, это:
а) взвешенные вещества;
б) ионные и молекулярные системы ;
в) мицеллы.
115. Буферные растворы обеспечивают:
а) постоянную t;
б) постоянную степень минерализации;
в) постоянное рН;
116. Бактерии и вирусы, находящиеся в воде образуют:
а) зоогели и зооколлоиды;
б) истинные растворы;
в) эмульсии.
117. Уравнение Лэнгмюра описывает сорбцию при концентрации примесей:
а) менее 0,01 моль/л;
б) более 0,5 моль/л;
в) менее 0,5 моль/л.
118. Величина удельной электропроводности примерно показывает:
а) суммарную концентрацию всех катионов;
б) концентрацию неэлктролитов;
в) суммарную концентрацию электролита.
119. Восстановительный тип геохимической обстановки в природных водах характеризуется величиной редокс потенциала:
а) Еn = 0 – 100 мВ;
б) Еn < 0;
в) Еn =100 – 150 мВ.
ПРИЛОЖЕНИЕ
Таблица 2
Дата добавления: 2020-02-05; просмотров: 835;











