Диаграмма состояния двойных сплавов и их характер изменения
Диаграмма состояния – график, на котором показаны продукты взаимодействия компонентов сплава друг с другом в условиях термодинамического равновесия при различных температурах.
Фаза – определенная часть системы, образованная компонентами сплава, имеющая во всех точках одинаковый состав, строение и свойства.
Фаза – продукт взаимодействия, который имеет зависимость от температуры определенного агрегатного состояния, специфического характера строения и определенных свойств.
Жидкая фаза - раствор расплавленных компонентов.
Твердые фазы - зерна определенной формы свойств. Их можно наблюдать в микроскоп. Представляют собой 1 из 4 видов сплавов.
Диаграмма состояния разделена на области, которые могут состоять как из 1 фазы, так и из двух, имеющих разные свойства.
Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа.
В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки.
Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус.
По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.
Шкала концентраций показывает содержание компонента В. По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава. Определяют возможность термообработки; температуру нагрева для её проведения.
По анализу диаграммы определяют свойства данной системы и характер изменения их от состава.
По диаграмме определяют, как создать и обработать сплав.
Так как возможны 4 вида сплавов, то и диаграммы состояния существую для каждого из них.
Рассмотрим диаграмму состояния механической смеси.
|

 2 1
2 1
 | |||||||
 | |||||||
 | |||||||
 | |||||||
2 Ж
 1¢
1¢


 Ж Ж
Ж Ж














 Ж
Ж
|
А+Ж В+Ж
 l t s
l t s
А+Ж
c В+Ж
Эвт+ж Эвт+ж
Д Е конец кристалл.
 В+Эвт Эвт
В+Эвт Эвт
А+ЭВТ. В+ЭВТ А+Эвт (А+В)
ЭВТ
(А+В)
 Вэ В1 В,% 100 0 t,с
Вэ В1 В,% 100 0 t,с
Рис.3.3. Диаграмма состояния и кривая охлаждения сплава
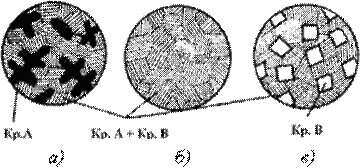
Рис. 3.4. Схема микроструктур сплавов: а – доэвтектического, б – эвтектического, в – заэвтектического
Характерна для смесей с отсутствием растворимости компонентов в твердом состоянии.
По оси ОХ диаграммы указывается процентная доля компонента В в сплаве, по оси ОУ – температура.
Фазовое строение зависит от температуры.
Рассмотрим характерные точки и линии диаграммы состояния.
Из диаграммы видно, что при взаимодействии компонентов температура перехода в жидкое состояние понижается.
Точке С соответствует минимальная температура перехода в жидкое состояние для определенного состава.
Вэ позволяет определить состав эвтектического сплава (т.е. состав сплава, при котором температура плавления минимальна).
tэ- температура, при которой одновременно плавятся или кристаллизуются оба компонента.
НСВ – линия ликвидуса (“жидкий” лат.) – выше Ж
ДСЕ – линия солидуса (“твердый”)
Переход из жидкого в твердое состояние происходит в промежутке между АСВ и ДСЕ
Переход сначала осуществляется тем компонентом, чей состав превышает эвтектическую концентрацию.
АСД - обл.- тв. А + Ж; СВ Е- т. В + Ж.
Ж.ф. раствор обоих компонентов.
По мере понижения температуры и приближения к температуре эвтектики состав незакристаллизировавшейся фазы приближается к эвтектическому Вэ (точка С). Чем меньше сплав отличается от эвтектического, тем ниже его точка ликвидуса и тем больше в нем затвердевает эвтектики.
Количество измерения подчиняется правилу отрезков.
Пример.
Сплав состояние 1 lts – произвольно взята температура ( изотерма).
Определим составы и число фаз.
Состав жидкой фазы всех з/эвт. сплавов, включая и сплав1, будет одинаковым и равным В1. Состав твердой фазы будет отличаться 100% содержанием компонента В. Состав жидкой фазы изменяется по линии ликвидуса СВ от исходного до эвтектического. Масса твердой фазы определяется величиной отрезка [lt], а жидкой [ts]. Если mq=[ls], то Qв/Q=lt/ls; Qж/Q=ts/ls. Так можно определить абсолютную m.
Доэвтектические сплавы А>(100-Вэ)% (А избыт.)
Заэвтектические сплавы В>Вэ (В избыт.)
Эвтектические сплавы А и В- мелкие
Избыточные зерна фаз – крупные
В доэвтектических сплавах А (кр.) + Эвт. (А+В) мелкие и наоборот.
Количество составляющих вычисляют по правилу отрезков. Эвтектические сплавы имеют большую прочность. Если бы размеры зерен были одинаковы, и изменение прочности шло бы по линейному закону. Рассчитать свойства можно по формуле s=ηsа+(-1-η)sв, т.к. полная реакция сплава на внешнее воздействие складывается из реакции зерен обеих фаз. Аналогичны и другие свойства.
Приведем примеры диаграмм состояний и температурных кривых охлаждения для других типов сплавов:
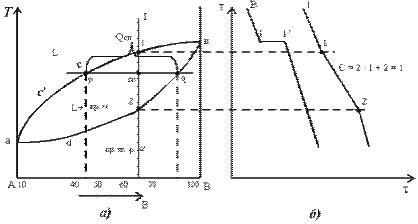
Рис.3.5 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (а); кривые охлаждения типичных сплавов (б)
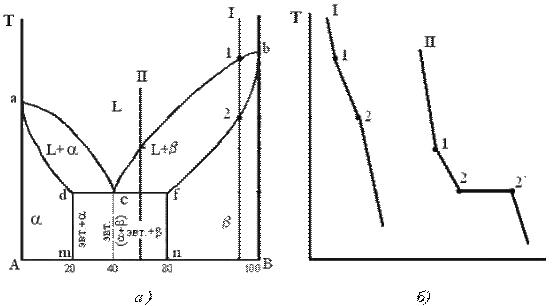
Рис. 3.6 Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (а) и кривые охлаждения типичных сплавов (б)
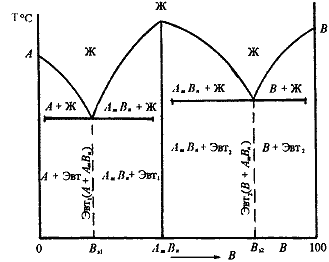
Рис. 3.7. Диаграмма состояния сплавов, компоненты которых образуют химические соединения
Дата добавления: 2019-12-09; просмотров: 1067;











