Азотсодержащие вещества
Азотсодержащие соединения составляют значительную часть сухого вещества продовольственных товаров. К ним относятся белки, аминокислоты, амиды аминокислот, нуклеиновые кислоты, аммиачные соединения, нитраты, нитриты и др.
Аминокислоты являются основными структурными компонентами молекул белка и в свободном виде появляются в продовольственных товарах в процессе распада белка.
Амиды аминокислот содержатся в растительных продуктах в качестве естественной составной части. Например, в капусте и спарже находится амид аспарагина (0,2-0,3%).
Аммиачные соединения встречаются в продовольственных товарах в малых количествах в виде аммиака и его производных. Аммиак является конечным продуктом распада белков. Значительное количество аммиака и аминов указывает на гнилостное разложение белков продовольственных товаров. Поэтому при исследовании свежести мяса и рыбы определяют содержание в них аммиака. К производным аммиака относятся моноамины CH3NH2, диметиламины (CH3)2NH и триметиламины (CH3)3N, которые обладают специфическим запахом. Метиламин имеет запах, сходный с аммиаком. Диметиламин – газообразное вещество с запахом селедочного рассола, образуется в основном при гниении белков рыбы и других продуктов. Триметиламин – газообразное вещество, содержащееся в значительном количестве в селедочном рассоле. В концентрированном виде обладает запахом аммиака, но в слабых концентрациях имеет запах гнилой рыбы.
Нитраты – соли азотной кислоты. В продовольственных товарах содержатся в незначительных количествах, за исключением тыквы и кабачков.
Нитриты добавляют в небольших количествах при посоле мяса и в колбасный фарш для придания мясу розового цвета. Нитриты обладают высокой токсичностью, поэтому применение их в пищевой промышленности лимитируется (в мясной колбасный фарш добавляют раствор нитрита из расчета не более 0,005% массы мяса).
Белки имеют наиболее важное из азотсодержащих соединений значение для питания человека. Они являются наиболее важными органическими соединениями, входящими в состав живых организмов. Еще в прошлом веке, изучая состав различных животных и растений, ученые выделили вещества, которые по некоторым свойствам напоминали яичный белок: так, при нагревании они свертывались. Это и дало основание назвать их белками. Значение белков как основы всего живого было отмечено еще Ф. Энгельсом. Он писал, что там, где есть жизнь, обнаруживаются белки, а где присутствуют белки, там отмечены признаки жизни.
Таким образом, термином «белки» назван большой класс органических высокомолекулярных азотсодержащих соединений, присутствующих в каждой клетке и определяющих ее жизнедеятельность.
Химический состав белков. Химический анализ показал наличие во всех белках (в %): углерода – 50-55, водорода – 6-7, кислорода – 21-23, азота – 15-17, серы – 0,3-2,5. В отдельных белках обнаружены фосфор, йод, железо, медь и некоторые макро- и микроэлементы в различных количествах.
Содержание основных химических элементов в отдельных белках может быть различным, за исключением азота, концентрация которого наиболее постоянна и в среднем составляет 16%.
Для определения химической природы мономеров белка проводят гидролиз – длительное кипячение белка с сильными минеральными кислотами или основаниями. Наиболее часто применяют 6N НNО3 и кипячение при 110°С в течение 24 ч. На следующем этапе разделяют вещества, входящие в состав гидролизата. Для этой цели применяют метод хроматографии. Наконец, природу выделенных мономеров выясняют с помощью определенных химических реакций. В результате было установлено, что исходными составными частями белков являются аминокислоты.
Молекулярная масса (м.м.) белков от 6000 до 1 000000 и выше, так, м.м. белка альбумина молока – 17400, глобулина молока – 35200, яичного альбумина – 45000. В организме животных и растений белок встречается в трех состояниях: жидком (молоко, кровь), сиропообразном (яичный белок) и твердом (кожа, волосы, шерсть).
Благодаря большой м.м. белки находятся в коллоидном состоянии и диспергированы (распределены, рассеяны, взвешаны) в растворителе. Большинство белков относится к гидрофильным соединениям, способны вступать во взаимодействие с водой, которая связывается с белками. Такое взаимодействие называется гидратацией.
Многие белки под влиянием некоторых физических и химических факторов (температура, органические растворители, кислоты, соли) свертываются и выпадают в осадок. Этот процесс называется денатурацией. Денатурированный белок теряет способность к растворению в воде, растворах солей или спирте. Все продовольственные товары, переработанные с помощью высоких температур, содержат денатурированный белок. У большинства белков температура денатурации составляет 50-60 ºС. Свойство белков денатурироваться имеет важное значение, в частности, при выпечке хлеба и получении кондитерских изделий. Одно из важных свойств белков – способность образовывать гели при набухании в воде. Набухание белков имеет большое значение при производстве хлеба, макаронных и других изделий. При «старении» гель отдает воду, при этом уменьшается в объеме и сморщивается. Это явление, обратное набуханию, называется синерезисом.
При неправильном хранении белковых продуктов может происходить более глубокое разложение белков с выделением продуктов распада аминокислот, в том числе аммиака и углекислого газа. Белки, содержащие серу, выделяют сероводород.
Человеку требуется 80–100 г белков в сутки, в том числе 50 г животных белков. При окислении 1 г белка в организме выделяется 16,7 кДж, или 4,0 ккал.
Содержание белков в продовольственных товарах составляет (в %):. в говядине – 17; свинине – 15,2; баранине – 15,2; яйцах – 12,8; треске – 16,5; пшеничной муке -- 10,5; молоке – 2,5-3,5; масле сливочном – 0,6; сыре – 22–29; картофеле – 2,0; орехах – 12-20; сое – 34,9.
Аминокислоты – это органические кислоты, у которых атом водорода α-углеродного атома замещен на аминогруппу NH2. Следовательно, это α-аминокислота с общей формулой
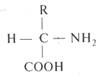
Следует отметить, что в составе всех аминокислот имеются общие группировки: -СН2, -NH2, -COOH, а боковые цепи аминокислот, или радикалы (R), различаются. Химическая природа радикалов разнообразна: от атома водорода до циклических соединений. Именно радикалы определяют структурные и функциональные особенности аминокислот.
Аминокислоты в водном растворе находятся в ионизированном состоянии за счет диссоциации аминных и карбоксильных групп, а также групп, входящих в состав радикалов. Другими словами, они являются амфотермными соединениями и могут существовать либо как кислоты (доноры протонов), либо как основания (акцепторы протонов).
Все аминокислоты в зависимости от структуры разделены на несколько групп (рис. 1.1).
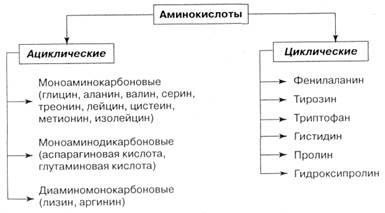
Рис. 1.1. Классификация аминокислот
Из 20 аминокислот, которые участвуют в построении белков, не все обладают одинаковой биологической ценностью. Некоторые аминокислоты синтезируются организмом человека, и потребность в них удовлетворяется без поступления извне. Такие аминокислоты называются заменимыми (гистидин, аргинин, цистин, тирозин, аланин, серии, глутаминовая и аспарагиновая кислоты, пролин, оксипролин, глицин). Другая часть аминокислот не синтезируется организмом и они должны поступать с пищей. Их называют незаменимыми (триптофан). Белки, содержащие все незаменимые аминокислоты, называются полноценными, а если отсутствует, хотя бы одна из незаменимых кислот – белок является неполноценным.
Классификация белков. В основу классификации белков положены их физико-химические и химические особенности. Белки делят на простые (протеины) и сложные (протеиды). К простым относят белки, которые при гидролизе дают только аминокислоты. К сложным – белки, состоящие из простых белков и соединений небелковой группы, называемой простетической.
К протеинам относятся альбумины (молока, яиц, крови), глобулины (фибриноген крови, миозин мяса, глобулин яиц, туберин картофеля и др.), глютелины (пшеницы и ржи), продамины (глиадин пшеницы), склеропротеины (коллаген костей, эластин соединительной ткани, кератин волос).
К протеидам относятся фосфопротеиды (казеин молока, вителлин куриного яйца, ихтулин икры рыб), которые состоят из белка и фосфорной кислоты; хромопротеиды (гемоглобин крови, миоглобин мышечной ткани мяса), представляющие собой соединения белка глобина и красящего вещества; глюкопротеиды (белки хрящей, слизистых оболочек), состоящие из простых белков и глюкозы; липопротеиды (белки, содержащие фосфатид) входят в состав протоплазмы и хлорофилловых зерен; нуклеопротеиды содержат нуклеиновые кислоты и играют важную для организма роль в биологическом отношении.
Витамины
Витамины – это низкомолекулярные органические соединения. Они служат биологическими регуляторами химических реакций обмена веществ, протекающих в организме человека, участвуют в образовании ферментов и тканей, поддерживают защитные свойства организма в борьбе с инфекциями.
В настоящее время открыто несколько десятков веществ, которые по действию на организм человека можно отнести к витаминам, но непосредственное значение для питания имеют только 20. Витамины обозначают буквами латинского алфавита: А, В, С, D и др. Кроме того, каждый из них имеет название, соответствующее химическому строению. Например, витамин С – аскорбиновая кислота, витамин D – кальциферол, витамин В1 – тиамин и т. д. Витамины, как правило, не синтезируются в организме человека, поэтому основным источником большинства из них являются продукты питания, а также синтезированные витаминные препараты. Суточная потребность организма человека в витаминах исчисляется в миллиграммах.
В случае отсутствия в пище витаминов могут возникать заболевания – авитаминозы. Недостаточное потребление витаминов вызывает гиповитаминоз, а избыточное потребление жирорастворимых витаминов – гипервитаминоз. Витамины находятся почти во всех продовольственных товарах. Некоторые товары подвергают витаминизации: витаминизированное молоко, сливочное масло, кондитерские изделия и т. д.
В зависимости от растворимости витамины подразделяют на водорастворимые – С, Р, группы В и жирорастворимые – A, D, E, К.
Водорастворимые витамины.Из них наиболее часто встречаются следующие.
Витамин С (аскорбиновая кислота) -- противоцинготный. Он играет важную роль в окислительно-восстановительных процессах организма, влияет на белковый, углеводный и холестериновый обмен. При недостатке витамина С в пище снижается сопротивляемость организма человека различным заболеваниям. Отсутствие его вызывает цингу. Суточная норма потребления витамина С – 50–70 мг. Содержится он в основном в свежих овощах и плодах; особенно много его в шиповнике, черной смородине и перце красном, имеется он также в зелени петрушки и укропа, луке зеленом, капусте белокочанной, томатах красных, яблоках, картофеле.
Витамин Р (рутин) обладает капилляроукрепляющим действием и снижает проницаемость стенок кровеносных сосудов. Суточная норма потребления витамина 25–35 мг. Содержится этот витамин в тех же растительных продуктах, в которых находится витамин С.
Витамины группы В: В1, В2, РР, В6, В12, В16, Н холин и др.
Витамин В1 (тиамин) играет важную роль в обмене веществ, особенно углеводном, в регулировании деятельности нервной системы. При недостатке его в пище наблюдаются расстройства нервной системы, кишечника. Отсутствие витамина в питании приводит к авитаминозу. Потребность в витамине В1в среднем 2–2,5 мг/сут. При недостатке в пище этого витамина ухудшаются состояние кожи, зрение, снижается функция желудочной секреции. Содержится витамин В2 в яйцах, сыре, молоке, мясе, рыбе, хлебе, крупе гречневой, овощах, фруктах, дрожжах.
Витамин РР (никотиновая кислота) является составной частью ферментов, участвующих в обмене веществ. Недостаток в пище витаминов РР вызывает утомляемость, слабость, раздражительность и заболевание пеллагрой. Суточная потребность в витамине 15–25 мг. Он содержится в продуктах растительного и животного происхождения.
Витамин В6(пиридоксин) участвует в обмене веществ. При недостатке его в питании наблюдается расстройство нервной системы, дерматиты, склеротические изменения сосудов. Суточная потребность 2–3 мг.
Витамин В9(фолиевая кислота) обеспечивает нормальное кроветворение в организме человека и участвует в обмене веществ. При недостатке фолиевой кислоты в питании развиваются различные формы малокровия. Суточная норма потребления этого витамина 0,2-0,3 мг. Много его в зеленых листьях (салат, шпинат, петрушка, зеленый лук).
Витамин В12 (кобаламин) играет важную роль в процессах регулирования кроветворения, в обмене белков, жиров и углеводов. При недостатке витамина В12 в организме развивается злокачественное малокровие. Потребность в витамине 0,002-0,005 мг/сут. Этот витамин содержится- только в продуктах животного происхождения: в мясе, печени, молоке, сыре, яйцах.
Витамин В15 (пангамовая кислота) участвует в окислительных процессах в организме, оказывая благоприятное действие на сердце, сосуды, кровообращение; особенно необходим пожилым людям. Суточная потребность в витамине около 2 мг. Содержится он в рисовых отрубях, дрожжах, печени и крови животных.
Холин влияет на белковый и жировой обмен, обезвреживает вредные для организма вещества. Отсутствие холина в пище способствует жировому перерождению печени, поражению почек. Потребность в холине 500-1000 мг/сут. Холин находится в продуктах животного и растительного происхождения (кроме овощей и фруктов): в рисе, в печени, мясе, желтке яиц, молоке.
Витамин Н (биотин) регулирует деятельность нервной системы. При недостатке этого витамина в питании отмечаются нервные расстройства с поражениями кожи. Потребность в биотине 0,15-0,3 мг/сут. Он частично синтезируется бактериями кишечника. В продуктах биотин представлен широко, но в небольших количествах (в печени, мясе, молоке, картофеле и др.). Витамин устойчив к кулинарной обработке.
Жирорастворимые витамины.К ним относятся следующие витамины.
Витамин А (ретинол) влияет на рост и нормальное развитие скелета, зрение, состояние кожи и слизистой оболочки, сопротивляемость организма инфекционным заболеваниям. При недостатке витамина А прекращается рост, выпадают волосы, организм истощается, нарушается зрение, особенно в сумерках («куриная слепота»). Суточная норма для взрослого человека 1,5-2,5 мг. Содержится витамин А в продуктах животного происхождения: в рыбьем жире, печени, яйцах, молоке, мясе. В продуктах растительного происхождения желто-оранжевого цвета и в зеленых частях растений (шпинате, салате) находится провитамин А – каротин, который в организме человека превращается в витамин А.
Витамин D (кальциферол) участвует в образовании костной ткани, способствует удержанию в ней солей кальция и фосфора, стимулирует рост. При недостатке в организме этого витамина у детей развивается рахит, а у взрослых изменяются костные ткани. Витамин D содержится в животной пище: в тресковой печени, палтусе, сельди, треске, печени говяжьей, сливочном масле, яйцах, молоке и др. Но в основном он синтезируется в организме из провитамина (вещества, содержащегося в коже) в результате воздействия ультрафиолетовых лучей.
Витамин Е (токоферол) влияет на процессы размножения. При недостатке этого витамина происходят изменения в деятельности половой и центральной нервной систем, нарушается деятельность желез внутренней секреции. Суточная потребность в витамине 10-20 мг. Витамин Е находится как в растительных, так и в животных продуктах, поэтому недостатка человек в нем не испытывает. Особенно много витамина Е в зародышах злаков и растительных маслах. Содержание его в продуктах при нагревании снижается. Витамин Е обладает антиокислительным действием и широко применяется в пищевой промышленности для замедления процесса окисления жиров.
Витамин К (филлохинон) участвует в процессе свертывания крови. При недостатке его замедляется свертывание крови и появляются подкожные внутримышечные кровоизлияния. Суточная потребность в витамине 0,2-3 мг. Большая часть этого витамина синтезируется бактериями в кишечнике человека. Витамин К содержится в основном в зеленых листьях салата, капусты, шпината, крапивы. Под действием света, высокой температуры и щелочей он разрушается.
Витаминоподобные вещества.Наибольшее значение имеют следующие вещества.
Витамин F (ненасыщенные жирные кислоты: линолевая, линоленовая, арахидоновая) участвует в жировом и холестериновом обмене. Суточная норма потребления витамина 5–8 г. Наилучшее соотношение ненасыщенных жировых кислот отмечено в свином сале, арахисовом и оливковом маслах.
Витамин U нормализует секреторную функцию пищеварительных желез, содержится в соке капусты, картофеле, зеленом чае и молоке.
Ферменты
Ферменты (энзимы) – это биологические катализаторы белковой природы, обладающие способностью активизировать различные химические реакции, происходящие в живом организме.
Образуются ферменты в любой живой клетке и могут проявлять активность вне ее. Действие ферментов строго специфично, т. е. каждый фермент катализирует только одну или несколько близких химических реакций. Поэтому название их складывается из названия вещества, на которое они действуют, и окончания «аза». Например, фермент, расщепляющий сахарозу, называют сахаразой, лактозу – лактазой. Ферменты обладают очень большой активностью. Ничтожной дозы их достаточно для превращения огромного количества вещества из одного состояния в другое. Ферменты характеризуются определенными свойствами. Так, некоторые ферментативные процессы обратимы, т. е. в зависимости от условий одни и те же ферменты могут ускорять как процесс распада, так и процесс синтеза вещества. Они чувствительны к изменению температуры. Наивысшую активность ферменты проявляют при температуре 40-50 ºС. Поэтому для предупреждения порчи продукты хранят на холоде или подвергают тепловой обработке.
Ферменты играют важную роль в производстве продовольственных товаров, в процессе их хранения и кулинарной обработки. Для изготовления сыров используют сычужные ферменты. В производстве кисломолочных продуктов, квашеных овощей и брожении теста участвуют ферменты, которые выделяют бактерии и дрожжи. Ферменты существенно влияют на качество продуктов. В одних случаях это влияние положительно, например созревание мяса после убоя животных и сельди и лососевых рыб при посоле, в других случаях – отрицательно, например потемнение яблок, картофеля при очистке и нарезке. Под действием ферментов окисляются жиры. Прокисание супов, гниение фруктов, брожение компотов и варенья вызывают ферменты, выделяемые попавшими в пищу микробами. Для прекращения отрицательного действия ферментов применяют нагревание или понижение температуры хранения продуктов.
По современной классификации все ферменты делят на шесть классов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Каждый класс подразделяют на подклассы, а каждый подкласс – на группы.
Оксидоредуктазы.Это ферменты, катализирующие окислительно-восстановительные реакции, которые протекают в живых организмах.
В классе оксидоредуктаз основное значение имеют дегидрогеназы, которые осуществляют реакцию дегидрирования. Все дегидрогеназы делят на две группы: анаэробные и аэробные, которые называют оксидазами.
Анаэробные дегидрогеназы представляют собой специфические ферменты, катализирующие отщепление водорода от определенных химических веществ и передающие его другим ферментам – переносчикам водорода. Так, лактатдегидрогеназа катализирует реакцию окисления молочной кислоты до пировиноградной, изоцитратдегидрогеназа – окисление изолимонной кислоты до щавелево-янтарной.
К группе аэробных дегидрогеназ (оксидаз) относят ферменты, в состав которых в качестве кофермента входит витамин В2 (рибофлавин), поэтому их называют флавиновыми ферментами. Они способны отнимать водород от окисляемого вещества и передавать его другим соединениям или кислороду воздуха. К этой группе ферментов относятся полифенолоксидаза, аскорбинатоксидаза, глюко-оксидаза.
Трансферазы, или ферменты переноса.Они ускоряют перенос целых атомных групп от одного соединения к другому. Трансферазы имеют огромное значение для обмена веществ в живых организмах. В зависимости от характера переносимых группировок различают аминотрансферазы, фосфортрансферазы, глюкозилтрансферазы, ацилтрансферазы и др.
Аминотрансферазы ускоряют реакцию переаминирования аминокислот с кетокислотами.
Фосфортрансферазы ускоряют перенос остатков фосфорной кислоты на спиртовые, карбоксильные, азотсодержащие и другие группы тех или иных органических соединений.
Глюкозилтрансферазы катализируют реакции переноса глюкозидных остатков с молекул фосфорных эфиров или других соединений к молекулам моносахаридов, полисахаридов или других веществ.
Гидролазы.Эти ферменты катализируют гидролиз, а иногда и синтез органических соединений при участии воды. Этот класс подразделяют на 9 подклассов. Наиболее важными являются четыре подкласса гидролаз: эстеразы, карбогидразы, амидазы и пептидазы.
Эстеразы ускоряют реакции гидролиза и синтеза сложных эфиров. К ним относятся липазы, лецитиназы и другие ферменты.
Карбогидразы расщепляют глюкозидные связи в углеводах и их производных. К ним относятся мальтаза, лактаза, пектиназа и др.
Амидазы ускоряют гидролиз амидов кислот. К ним относятся пурин- и пирамидиндезаминазы, ациламидазы, амидиназы и др.
Пептидазы катализируют реакции расщепления белка и полипептидов.
Лиазы.Они объединяют ферменты, ускоряющие негидротические реакции распада органических-веществ с отщеплением воды, углекислого газа или аммиака и др. Некоторые из этих реакций обратимы, и соответствующие ферменты при определенных условиях катализируют реакции не только распада, но и синтеза.
Изомеразы.Они катализируют превращение органических соединений в их изомеры. В отличие от трансферазы измеразы катализируют перенос групп только внутри молекул. Эти превращения могут состоять во внутримолекулярном переносе водорода, фосфатных и ацетильных групп, в изменении пространственного расположения атомных группировок, в перемещении двойных связей. Изомеразы играют важную роль в обмене веществ.
Лигазы (синтетазы).Это большая группа ферментов, ускоряющих синтез сложных органических соединений из более простых. Реакция синтеза требует значительной затраты энергии, поэтому активность лигаз проявляется лишь в присутствии таких макроэнергетических соединений, как аденозинтрифосфорная кислота (АТФ) или другой нуклеотидтрифосфат. При отрыве от молекул АТФ в присутствии лигаз одного или двух концевых остатков фосфорной кислоты выделяется большое количество энергии, используемой для активирования реагирующих веществ.
Ферменты способны осуществлять каталитические функции вне клетки и вне организма, поэтому для практических целей представляет большой интерес выделение ферментов и их использование в пищевой, легкой, медицинской и некоторых других отраслях промышленности, на предприятиях общественного питания. Применение ферментов позволяет в большинстве случаев интенсифицировать технологические процессы, повышать качество готового продукта, улучшать его товарный вид, снижать себестоимость производства, расширять сырьевые ресурсы.
Дата добавления: 2021-11-16; просмотров: 895;











