Структура атома, постулаты Бора и периодическая система химических элементов
Представление об атомах как неделимых мельчайших частицах вещества ("atomos" - неделимый) возникло ещё в античные времена (Демокрит, Эпикур, Лукреций). К началу 18 века атомистическая теория вновь стала популярной, так как к тому времени в работах А. Лавуазье, М.В. Ломоносова и Д. Дальтона была доказана реальность существования атомов. Однако в то время вопрос о внутреннем строении атомов даже не возникал, атомы по-прежнему считались неделимыми.
Большую роль в развитии атомистической теории сыграл Д.И. Менделеев, разработавший в 1869 году Периодическую систему химических элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. В конце XIX века было экспериментально доказано, что в состав атомов входят электроны, и вопрос о строении атома стал актуальным.
Первая попытка создания модели атома на основе накопленных экспериментальных данных принадлежит Дж. Томсону (1903 г.). Согласно этой модели (названной "моделью пудинга"), атом представляет собой однородный положительно заряженный шар радиусом порядка 10-10 м, в который внедрены (как изюминки в пудинг) отрицательно заряженные электроны; суммарный заряд атома равен нулю, поэтому атом в целом электрически нейтрален. Однако расчёты показали, что такая система является неустойчивой, что противоречило факту стабильности атомов.
В 1911 году английский физик Эрнест Резерфорд выполнил опыты по рассеянию a-частиц (ядер атомов гелия) веществом (золотой фольги толщиной ~ 1 мкм). Оказалось, что лишь некоторые a-частицы (примерно одна из 20000) отклонялись на 180o, остальные - незначительно рассеивались. Так как электроны не могут существенно изменить движение столь тяжёлых и быстрых (их скорость »107 м/с) частиц, как a-частицы, то Резерфорд сделал вывод, что значительное отклонение a-частиц обусловлено их взаимодействием с положительно заряженной частицей большой массы. Однако значительное отклонение испытывают лишь немногие a-частицы, следовательно, лишь некоторые из них проходят вблизи этого положительного заряда. Значит, положительный заряд сосредоточен в объёме, значи
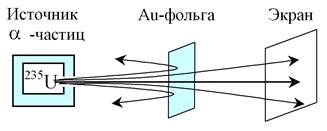 |
тельно меньшем объёма атома.
На основании своих исследований Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома расположено ядро, имеющее положительный заряд 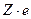 (где Z - порядковый номер элемента в таблице Менделеева,
(где Z - порядковый номер элемента в таблице Менделеева, 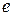 - заряд электрона), размер
- заряд электрона), размер 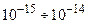 м и массу, практически равную массе атома (
м и массу, практически равную массе атома ( 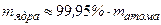 ). Вокруг ядра по орбитам с диаметрами порядка
). Вокруг ядра по орбитам с диаметрами порядка  м движутся (чтобы не упасть на ядро из-за кулоновского притяжения) электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра вращаются Z электронов. Причём ограничений на величины радиусов орбит электронов планетарная модель не накладывает.
м движутся (чтобы не упасть на ядро из-за кулоновского притяжения) электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т.е. вокруг ядра вращаются Z электронов. Причём ограничений на величины радиусов орбит электронов планетарная модель не накладывает.
Однако: 1) эксперименты показали, что атомы имеют линейчатые спектры излучения и поглощения; 2) при радиусах орбит электронов 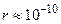 м, скорость J их движения (исходя из равенства центробежной и кулоновской сил) должна быть
м, скорость J их движения (исходя из равенства центробежной и кулоновской сил) должна быть  м/с, а ускорение
м/с, а ускорение  . Но, согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и, вследствие этого, непрерывно терять энергию. В результате электроны будут приближаться к ядру и, в конце концов, упадут на него. Таким образом, атом Резерфорда также оказывается неустойчивой системой, что противоречит действительности.
. Но, согласно классической электродинамике, ускоренно движущиеся электроны должны излучать электромагнитные волны и, вследствие этого, непрерывно терять энергию. В результате электроны будут приближаться к ядру и, в конце концов, упадут на него. Таким образом, атом Резерфорда также оказывается неустойчивой системой, что противоречит действительности.
Преодоление возникших трудностей потребовало создание качественно новой - квантовой модели атома. Основы этой модели были заложены в 1913году датчанином Нильсом Бором.Он поставил перед собой цель связать в единое целое известную линейчатость спектров, планетарную модель атома Резерфорда и квантовый характер излучения и поглощения света. Свою теорию Н. Бор разработал, предположив (в качестве постулатов), что:
1) электроны вращаются в атоме не по любым орбитам, а только по орбитам со строго определёнными радиусами 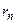 , удовлетворяющими равенству:
, удовлетворяющими равенству: 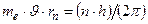 , где n=1, 2, 3 …. – главное квантовое число;
, где n=1, 2, 3 …. – главное квантовое число;
2) движение электронов по этим стационарным орбитам не сопровождается излучением (или поглощением) фотонов (электромагнитных волн);
3) переход электрона с n-й на k-ю орбиту сопровождается переходом атома из состояния с энергией 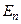 в состояние с энергией
в состояние с энергией 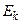 , при этом электрон может излучить (или поглотить) фотон с энергией:
, при этом электрон может излучить (или поглотить) фотон с энергией: 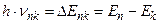 . При
. При 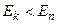 происходит излучение фотона, при
происходит излучение фотона, при  - поглощение фотона. Набор возможных дискретных частот
- поглощение фотона. Набор возможных дискретных частот 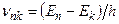 квантовых переходов и определяет линейчатый спектр излучения - поглощения атома.
квантовых переходов и определяет линейчатый спектр излучения - поглощения атома.
Состояние атома в простой модели Бора характеризуют единственным квантовым числом n, определяющим номер электронной оболочки атома и называемым главным квантовым числом. Но объяснить тонкую структуру спектра атома (даже простейшего из них – атома водорода) только значениями n невозможно. Основным недостатком квантовой теории атома по Бору являются: 1) недостаточная обоснованность; 2) неприменимость к описанию сложных атомов, она оказалась справедлива лишь для атома водорода.
Новым шагом в разработке модели структуры атома явилась модель немецких физиков Шрёдингера и Гейзенберга. Согласно этой модели:
1) орбиты электронов могут быть не только круговыми, но и эллиптическими, так как и в этом случае, центростремительная сила (обусловленная кулоновским притяжением) направлена к одной точке – одному из фокусов эллипса, в котором находится ядро. Эксцентриситет эллиптической орбиты (степень её вытянутости) оказывается, также квантуется, т.е. может быть не любым, а только определённым. Установлено, что n-й круговой орбите соответствует (n-1) эллиптических орбит. Поэтому пришлось ввести второе квантовое число – орбитальное l.
2) вращающийся вокруг ядра электрон можно рассматривать как микроток, протекающий по замкнутому контуру. Но любой ток имеет свое магнитное поле. Взаимодействие магнитных полей данного электрона и других электронов атома приводит к постоянному вращению (прецессии) магнитного поля данного электрона. Причём направление и модуль скорости прецессии магнитного поля электрона также квантуются. В связи с чем, ввели магнитное квантовое число – m.
3) электроны представляют собой объекты, вращающиеся не только вокруг ядра, но и вокруг своей оси. Поэтому каждый электрон характеризуется некоторым моментом импульса, который в случае элементарных частиц называют спином. Оказалось, что все электроны имеют одинаковый по модулю спин, но направление спина вдоль собственной оси вращения электрона возможно двоякое: либо «вверх», либо «вниз», т.е. спин также квантован. В связи с этим ввели четвёртое квантовое число – спиновое S, которое может принимать только два противоположных по знаку значения: +  и -
и -  (где
(где 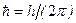 ).
).
Итак, состояние электрона, входящего в состав некоторого атома, характеризуют четыре квантовые числа: n, l, m и s. Электрон может находится только в состояниях, определённых квантовыми числами. Эти состояния стационарны. Любое изменение состояния происходит с изменением хотя бы одного квантового числа. Если атом принимает энергию (например, поглощает свет) или отдаёт её (например, испускает свет), то хотя бы один из его электронов меняет набор квантовых чисел, а сам атом переходит из одного энергетического состояния в другое.
Шрёдингер и Гейзенберг развили теорию Бора и создали квантовую механику, которая в настоящее время и является наиболее совершенной теорией атома.
Квантовая модель (теория) атома позволила истолковать периодическую систему химических элементов. Теория связывает наиболее важные физические и химические свойства атомов со структурой электронной оболочки, и основой истолкования служит так называемый принцип построения. Согласно этому принципу, электронная оболочка любого атома получается из электронной оболочки предыдущего атома путём добавления к ней дополнительного электрона. Электронные оболочки имеют определённую структуру и состоят из электронных слоёв. Основой слоистой модели является главное квантовое число n. Электроны с одинаковым n принадлежат к одинаковым электронным слоям. В ближайшем к ядру электронном слое находятся электроны с n=1, на следующем слое находятся электроны с n=2 и т.д.
В одном и том же слое может быть несколько электронов, но не сколько угодно. Их число ограничивается принципом Паули. Согласно этому принципу, в атоме не может быть двух электронов с одинаковыми четырьмя (n, l, m, s) квантовыми числами. Если подсчитать возможности, относящиеся к данному квантовому числу n, то окажется, что число их равно 2 n2. Так, в 1-м слое может находиться не больше 2 электронов, во 2-м – не больше 8, в 3-м – 18, в 4-м – 32 и т.д.
В начале нового периода системы элементов всегда появляется новый электронный слой, и элементы, у которых количество и расположение наружных электронов совпадает, проявляют сходные химические свойства. Таковы, например, щелочные металлы (Li, Na, K, Rb и т.п.), у которых один электрон во внешнем электронном слое, и щёлочноземельные металлы (Ве, Мg, Ca, Sr, Ba, Ra), у которых два электрона в наружном слое.
Химические свойства атома определяются, в основном, электронами его наружного слоя. Эти электроны называют валентными. Они определяют также и спектр излучения атома в оптическом диапазоне.
Дата добавления: 2019-12-09; просмотров: 485;











