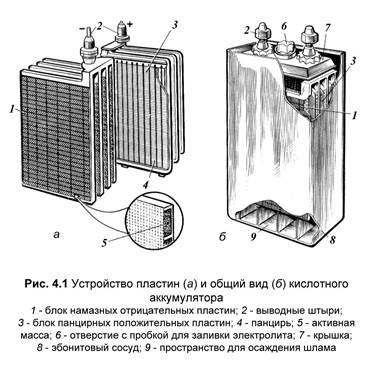
Кислотные аккумуляторы.
Химические источники тока.
Подразделяются на:
· Аккумуляторы (работа в режиме разряда и заряда)
· Гальванические элементы (работа только в режиме разряда)
Кислотные аккумуляторы.
Состоят из диэлектрического корпуса, наполненного электролитом (30% серной кислоты - H2SO4 в дистиллированной воде - H2O). В корпус помещен комплект пластин – электродов покрытыми активными массами.
Активной массой Анода (+)является оксид свинца(PbO2), а активной массой Катода (-) -чистый губчатый свинец (Pb).
Пластины ставятся в ряд, чередуются и разделяются сепараторными перегородками. Внизу корпуса имеется поддон дляосаживания свинцового осадка - шлама.
При разряде идет реакция
PbO2+Pb+2H2SO4<=>2PbSO4+2H2O
 т.е. активные массы вступают в реакцию с серной кислотой с образованием сульфата свинца (PbSO4) похожего на соль, и воды. При этом концентрация серной кислоты и плотность электролита понижается, а на электродах поддерживается около 2-х вольт на одну банку, а т.к. сульфат свинца это твердое кристаллическое вещество, то разряжать кислотный аккумулятор много нельзя (около 20%), т.к. возможно замыкание электродов. При разряде, т.е. подключении внешнего источника тока, идет обратная реакция, т.е. сульфат свинца растворяется в воде, при этом восстанавливаются активные массы и концентрация серной кислоты, повышается плотность электролита и напряжение (до14В на 6 банок), которое после отключения источника сравнительно быстро опускаются до 12В.
т.е. активные массы вступают в реакцию с серной кислотой с образованием сульфата свинца (PbSO4) похожего на соль, и воды. При этом концентрация серной кислоты и плотность электролита понижается, а на электродах поддерживается около 2-х вольт на одну банку, а т.к. сульфат свинца это твердое кристаллическое вещество, то разряжать кислотный аккумулятор много нельзя (около 20%), т.к. возможно замыкание электродов. При разряде, т.е. подключении внешнего источника тока, идет обратная реакция, т.е. сульфат свинца растворяется в воде, при этом восстанавливаются активные массы и концентрация серной кислоты, повышается плотность электролита и напряжение (до14В на 6 банок), которое после отключения источника сравнительно быстро опускаются до 12В.
Также недостатком кислотного аккумулятора является относительно быстрый саморазряд (1,5% в сутки, 20% в месяц).
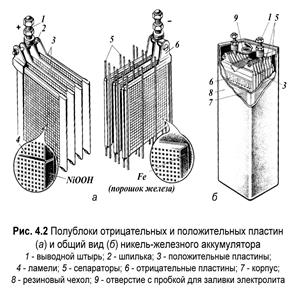
Вщелочном аккумуляторе электролитом является раствор щелочи, натрия или калия. Активными массами никель – железо (Ni-Fe), никель – кадмий (Ni-Cd), литий (Li) – ион (полимер).
Режимы разряда и заряда.Электрохимические реакции при разряде и заряде никель-железного аккумулятора могут быть выражены уравнением:
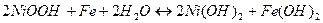
Читая уравнение слева направо, получаем процесс разряда, справа налево – процесс заряда.
Аналогичное уравнение отражает процессы разряда и заряда никель-кадмиевого аккумулятора.
 Электролит в процессе электрохимических реакций не расходуется, поэтому его плотность не изменяется.
Электролит в процессе электрохимических реакций не расходуется, поэтому его плотность не изменяется.
Полностью заряженный аккумулятор имеет ЭДС около 1,45 В. При разряде напряжение аккумулятора довольно быстро падает до 1,3 В, а затем медленно уменьшается до 1 В. При этом напряжении разряд следует прекращать. Разряжать щелочные аккумуляторы ниже установленного конечного напряжения не рекомендуется, так как это может привести к безвозвратной потере емкости и уменьшению срока службы.
При заряде напряжение быстро поднимается до 1,75 В, а затем медленно повышается до 1,8В. Выделение газа у щелочных аккумуляторов не является признаком окончания заряда, однако при бурном газовыделении необходимо уменьшить зарядный ток. Щелочные аккумуляторы лучше перезарядить, чем недозарядить.
Преимущества щелочных аккумуляторов:
· они могут долгое время находиться в в полузаряженном или полностью разряженном состоянии;
· не боятся низких температур;
· могут работать при больших разрядных и зарядных токах, т.к имеют большое внутреннее сопротивление;
· не боятся коротких замыканий и глубоких разрядов;
· не боятся тряски, вибраций, ударов;
· имеют большой срок службы и хранения.
Недостатки:
· напряжение щелочного аккумулятора почти на 40% ниже напряжения кислотного;
· из-за большего внутреннего сопротивления падение напряжения в щелочном аккумуляторе больше, чем в кислотном, особенно при больших токах разряда.
Основной характеристикой аккумуляторов является ёмкость ( С) , которая измеряется в Ампер-часах (А*ч).
Емкость показывает – какое количество электричества может отдать аккумулятор, разрядившись при этом полностью, т.е до U=0(В)
Номинальная ёмкость (является паспортной характеристикой аккумулятора) показывает, какое количество электричества может отдать аккумулятор, разряжаясь номинальным разрядным током до допустимого напряжения. Uдоп. одного элемента (банки) щелочных аккумуляторов – 1В, кислотных – 1,7 В.
Примечание: если аккумулятор разряжать током ниже номинального, то емкость аккумулятора повышается, и наоборот. Если разряжать аккумулятор током свыше номинального, то емкость снижается.
V Раздел.
Переменный ток.
Получают обычно с помощью 3-х фазных синхронных генераторов или с помощью 1-но фазных генераторов, которые в отличии от генераторов постоянного тока вместо коллектора имеют 2 контактных кольца.
Дата добавления: 2018-05-10; просмотров: 1246;











