Стабілізація подвійної спіралі
Два полінуклеотидні ланцюги (ДНК, РНК або гібридні) можуть об’єднуватись в єдину дволанцюгову структуру (дуплекс), схему якої зображено на рис. 5. Таке об’єднання відбувається за жорсткої умови: певні азотисті основи повинні стояти одна проти одної − А проти Т (чи U), G проти C. Цей принцип комплементарності, сформульований Уотсоном і Кріком (James D. Watson, Francis H.C. Crick), зумовлений утворенням специфічних водневих зв’язків між названими основами: два зв’язки в парі АТ, три в парі GC. Два ланцюги при цьому спрямовані в різні боки (є антипаралельними), цукрофосфатні остови розташовані зовні, пари основ − усередині цієї структури.
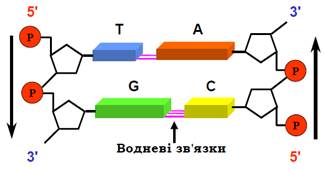
Рис. 5. Схема об’єднання двох динуклеотидів у дволанцюгову структуру.
У складі такого дволанцюгового комплексу неполярні площини сусідніх пар основ мають наблизитися одна до одної, і відносна гнучкість остовів дозволяє це зробити простим шляхом − закрутити два ланцюги один навкруг одного у подвійну спіраль (рис. 6). Усередині формується стопка (stack) щільно укладених одна на одну пар основ, захищена на поверхні спірально закрученими один навкруг одного полярними цукрофосфатними остовами. Між остовами на поверхні спіралі утворюються два жолобки різного розміру – великий і маленький (major/minor groove), в які дивляться донорні та акцепторні групи азотистих основ (рис. 7): у великому жолобку міститься по два акцептори (O, N) та одному донору (NH2) водневого зв’язку кожної пари; у маленькому − два акцептори пари АТ, два акцептори й один донор пари GC.
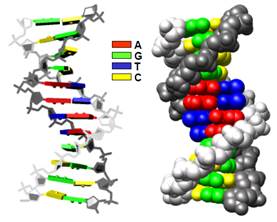
Рис. 6. Два варіанти представлення подвійної спіралі ДНК (кристалічна структура додекамеру, 355D).
Таким чином, цілком подібно до білків, гідрофобні взаємодії між площинами пар азотистих основ зумовлюють формування подвійної спіралі. При цьому реалізується щільна упаковка − утворюються вандерваальсові контакти між сусідніми парами.
Велика кількість таких контактів уздовж осі спіралі робить їх суттєвим фактором стабілізації дуплекса. Вандерваальсові взаємодії між парами основ є за своїм характером орієнтаційними та, унаслідок нерівномірності розподілу електронної щільності по кільцях основ, диполь-дипольними. Такі взаємодії складного характеру (гідрофобний ефект + вандерваальсові взаємодії) у складі стопки мають спеціальну назву – стекінг-взаємодії.
Отже, стекінг-взаємодії − головний фактор стабілізації подвійної спіралі. Точніше, це практично єдиний фактор стабілізації. Роль комплементарних водневих зв’язків між основами, які самі по собі енергетично не дуже важливі (водневі зв’язки основ із водою при розходженні ланцюгів майже такі самі), полягає в тому, що вони є необхідною передумовою утворення стабільної стопки.
Це знову цілком аналогічно ролі водневих зв’язків між пептидними групами вторинної структури білків у стабілізації глобули. Донорні й акцепторні групи азотистих основ прагнуть утворити водневі зв’язки (енергія водневого зв’язку є надто високою, щоб його втрачати). Опиняючись усередині неполярної стопки, вони стають недоступним для води і єдиний шанс зберегти водневі зв’язки − утворити їх із відповідними групами іншої основи. А це можливо лише за умови комплементарності. Відповідно, за відсутності комплементарності водневі зв’язки з водою зберігаються, що робить подвійну спіраль нестабільною.
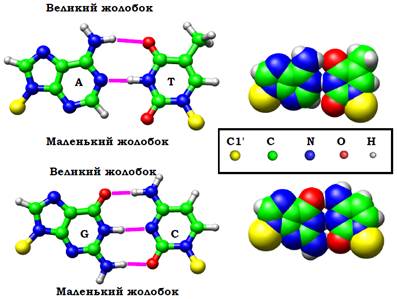
Рис. 7. Комплементарні пари основ у складі ДНК з водневими зв’язками між основами. Праворуч: атоми тих самих пар зображені відповідно до їхніх вандерваальсових радіусів.
Ефективність стекінг-взаємодій залежить від типу контактуючих пар основ, а також їхньої взаємної орієнтації та порядку розташування в ланцюгах дуплекса − типу динуклеотидного контакту вздовж осі подвійної спіралі. Замість 16 типів динуклеотидних контактів у одноланцюговій нуклеїновій кислоті, у подвійній спіралі залишається 10 − унаслідок комплементарності ланцюгів певні контакти є еквівалентними. Наприклад, контакт AG в одному ланцюзі автоматично означає, що в комплементарному ланцюзі реалізується контакт CT. Слід пам’ятати, що ланцюги є антипаралельними, і що послідовність нуклеотидів читається в напрямку 5′ → 3′ (усі динуклеотидні контакти подвійної спіралі наведено в табл. 2). Для певних контактів (наприклад, пурин-піримідинових порівняно з піримідин-пуриновими) стекінг-взаємодії є більш ефективними. Відповідно, стабільність подвійної спіралі залежить від послідовності пар основ.
Утворення подвійної спіралі працює проти конформаційної ентропії: розходження двох ланцюгів супроводжується значним зростанням їхньої конформаційної свободи (невпорядкованості). Відповідно, стабільність подвійної спіралі залежить від температури: при зростанні температури ентропійна компонента вільної енергії збільшується, і відбувається розходження ланцюгів – плавлення подвійної спіралі. Зрозуміло, що температура плавлення − температура за якої 50 % пар основ є розплавленими − є мірою стабільності й залежить від послідовності пар основ.
Суттєвий дестабілізуючий внесок у вільну енергію подвійної спіралі дають також електростатичні взаємодії. Оскільки кожен фосфатний залишок несе на собі негативний заряд (рис. 4), молекула ДНК є гігантським поліаніоном із високою поверхневою щільністю зарядів.
У розчині ці заряди суттєво нейтралізовані проти-іонами − неорганічними катіонами: навколо ДНК утворюється − іонна атмосфера − з досить високою локальною щільністю катіонів, тобто в системі виникає нерівномірний розподіл катіонів − зростає відповідна ентропійна компонента вільної енергії. Цей невигідний ефект буде тим меншим, чим вищою є концентрація солі в розчині, тобто різниця між концентрацією катіонів поблизу від ДНК і на віддаленні від неї. Відповідно, стабільність подвійної спіралі (і температура плавлення) залежить від іонної сили розчину − зростає при підвищенні концентрації солі.
За фізіологічних умов подвійна спіраль є досить стабільною структурою, і саме в цій формі ДНК (і значна частина комплементарних ділянок РНК) існує в живих системах. Розходження ланцюгів, яке має тимчасово відбуватися при різноманітних функціональних процесах, потребує виконання роботи молекулярними машинами з використанням енергії гідролізу АТР.
Дата добавления: 2018-05-10; просмотров: 1261;











