Температуры. Уравнение Больцмана
Температура тела является мерой средней кинетической энергии 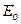 хаотического движения его молекул. Но к отдельным молекулам понятие температуры не применимо.
хаотического движения его молекул. Но к отдельным молекулам понятие температуры не применимо.
Установим взаимосвязь Ти 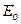 . Приравняв правые части уравнений Клаузиуса и Клапейрона-Менделеева, получим
. Приравняв правые части уравнений Клаузиуса и Клапейрона-Менделеева, получим 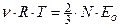 . Откуда:
. Откуда:

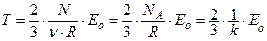 или
или 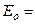
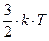 .
.
Это и есть уравнение Больцмана, где k= 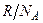 = 1,38
= 1,38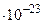
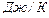 - постоянная Больцмана.
- постоянная Больцмана.
Подставив уравнение Больцмана в 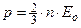 , получим уравнение Клапейрона - Менделеева в виде:
, получим уравнение Клапейрона - Менделеева в виде: 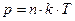 . Откуда:
. Откуда: 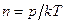 или
или 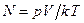 , т.е. при одинаковом давлении и температуре одинаковые объёмы всех газов содержат одинаковое число молекул. Так, например, в1м3 любого газа при нормальных условиях содержится
, т.е. при одинаковом давлении и температуре одинаковые объёмы всех газов содержат одинаковое число молекул. Так, например, в1м3 любого газа при нормальных условиях содержится 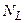 (число Лошмидта) молекул:
(число Лошмидта) молекул:
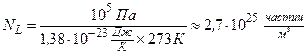 .
.
Оценим среднеквадратичную скорость 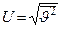 хаотического движения молекул газа. Из определения кинетической энергии имеем:
хаотического движения молекул газа. Из определения кинетической энергии имеем: 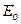 =
= 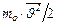 . Но, согласно уравнению Больцмана:
. Но, согласно уравнению Больцмана: 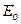 =
= 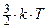 . Приравняем правые части этих выражений:
. Приравняем правые части этих выражений: 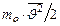 =
= 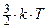 , откуда получим:
, откуда получим: 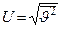 =
= 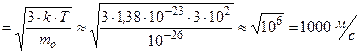 .
.
Некоторые другие характеристики движения молекул в газах (при нормальных условиях): 1) длина свободного пробега (расстояние, проходимое молекулой между двумя последовательными соударениями с другими молекулами газа) ~500 Å=50нм;2) время свободного пробега (время между последовательными соударениями молекулы): ~ 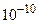 с.
с.
Дата добавления: 2019-12-09; просмотров: 276;










