Состав ядер. Изотопы
Для обозначения ядер применяют символ 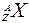 , где Х - химический символ элемента, A - массовое число ядра, выраженное в а.е.м. и равное (с учётом того, что
, где Х - химический символ элемента, A - массовое число ядра, выраженное в а.е.м. и равное (с учётом того, что  1 а.е.м.) сумме числа протонов Z и числа нейтронов
1 а.е.м.) сумме числа протонов Z и числа нейтронов  , т.е. A =
, т.е. A = 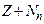 . Число протонов Z, входящих в состав ядра, определяет порядковый номер элемента в периодической таблице элементов и его заряд
. Число протонов Z, входящих в состав ядра, определяет порядковый номер элемента в периодической таблице элементов и его заряд  ; число Z называют атомным
; число Z называют атомным
 |
номером или зарядовым числом ядра.
В реальных ядрах  ; причём, чем больше
; причём, чем больше 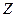 , тем сильнее это неравенство. Более того, в природе существуют ядра с одинаковыми
, тем сильнее это неравенство. Более того, в природе существуют ядра с одинаковыми 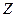 , но с разными
, но с разными  . Такие вещества назвают изотопами, т.е. занимающими место в одной и той же клетке периодической системы химических элементов.
. Такие вещества назвают изотопами, т.е. занимающими место в одной и той же клетке периодической системы химических элементов.
Изотопы- разновидности атомов химического элемента с одинаковыми 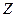 , отличающиеся количеством нейтронов в ядре. Например, известны четыре изотопа водорода:
, отличающиеся количеством нейтронов в ядре. Например, известны четыре изотопа водорода:  - протий,
- протий, 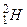 - дейтерий,
- дейтерий, 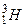 - тритий,
- тритий, 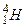 - четырёхнуклонный водород. В настоящее время установлено существование изотопов у всех химических элементов. Так как электронные оболочки изотопов одинаковы, то и их химические свойства (определяемые структурой электронных оболочек) почти одинаковы; но физические свойства изотопов (плотность, радиоактивность) различны. Существование изотопов доказывает, что заряд ядра определяет только химические свойства атома и те его физические свойства, которые зависят от электронной оболочки, например, размеры атома.
- четырёхнуклонный водород. В настоящее время установлено существование изотопов у всех химических элементов. Так как электронные оболочки изотопов одинаковы, то и их химические свойства (определяемые структурой электронных оболочек) почти одинаковы; но физические свойства изотопов (плотность, радиоактивность) различны. Существование изотопов доказывает, что заряд ядра определяет только химические свойства атома и те его физические свойства, которые зависят от электронной оболочки, например, размеры атома.
Отметим также тот факт, что в естественных условиях химически чистое вещество представляет собой смесь изотопов в различных пропорциях. Именно поэтому, несмотря на тщательный выбор эталона для а.е.м., атомные массы химических элементов в таблице Менделеева иногда сильно отличаются от целых чисел, поскольку в таблице приведены усреднённые атомные массы элементов с учётом процентного содержания их изотопов в природе.
Дата добавления: 2019-12-09; просмотров: 580;











