Ацилирование аммиака и аминов галогенангидридами и ангидридами карбоновых кислот
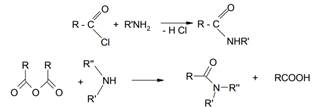
Ацилирование аммиака, первичных или вторичных аминов хлорангидридами или ангидридами карбоновых кислот приводит соответственно к первичным, вторичным и третичным амидам карбоновых кислот:

При получении амидов кислот из хлорангидридов и газообразного аммиака реакцию обычно проводят в растворителе (бензол, петролейный эфир, хлороформ, эфир). В данном случае газообразный аммиак можно вводить в раствор хлорангидрида кислоты или прибавлять хлорангидрид кислоты к раствору аммиака в растворителе при температуре -10 - 0С.
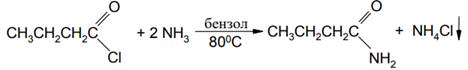
Например, при прибавлении хлорангидрида масляной кислоты к бензольному раствору аммиака был получен бутирамид с выходом 78-80 %:
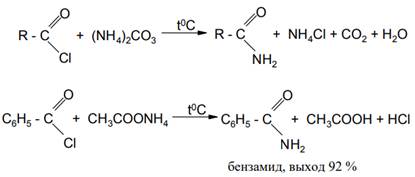
Для ацилирования аммиака удобнее всего нагревать хлорангидрид кислоты с карбонатом аммония или проводить взаимодействие хлорангидрида кислоты с ацетатом аммония в ацетоне при комнатной температуре:
Ацилирование первичных и вторичных аминов хлорангидридами кислот можно проводить аналогично ацилированию аммиака, при этом одна молекула амина расходуется на связывание выделяющегося хлористого водорода. В этом случае в зависимости от растворимости аминов реакцию можно вести как в водной, так и в безводной среде – в диэтиловом эфире, бензоле, хлороформе.
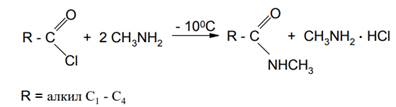
Например, при получении N-метиламидов низших алифатических кислот соответствующие хлорангидриды прибавляют по каплям к избытку водного раствора метиламина при -10 - 0С:
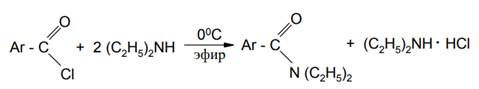
В то же время при получении N,N-диэтиламидов ароматических кислот к раствору диэтиламина в эфире при охлаждении прибавляют соответствующий хлорангидрид:
При ацилировании труднодоступных аминов выделяющийся хлористый водород связывают не самим амином, а более дешёвым основанием. При проведении синтеза в органическом растворителе для этой цели применяют безводные карбонаты щелочных металлов.
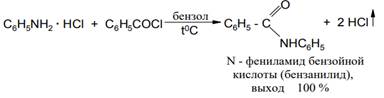
Иногда ацилирование алифатических и ароматических аминов проводят в отсутствие агентов, связывающих выделяющийся НС1, при длительном (10-20 ч) кипячении гидрохлоридов аминов с хлорангидридами кислот в инертном растворителе до прекращения выделения хлористого водорода:
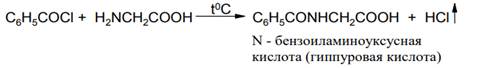
Таким же способом можно ацилировать аминокислоты, представляющие собой внутренние соли:
Для ацилирования аминов трудногидролизуемыми хлорангидридами ароматических кислот обычно используют метод Шоттена-Баумана - реакцию амина с хлорангидридом карбоновой кислоты в присутствии водной щелочи при комнатной температуре.
Ацилирование аминов алифатическими или другими реакционноспособными хлорангидридами данным методом проводят при охлаждении (0-10°С).

Для связывания образующегося по реакции Шоттена-Баумана галогеноводорода вместо гидроксида натрия или калия применяют также гидроксиды магния, кальция или бария, бикарбонат натрия или ацетат натрия.
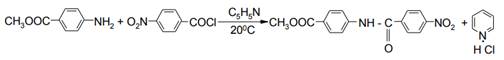
Во многих случаях хорошие результаты получают при использовании безводного пиридина, который одновременно служит растворителем. Например, при ацилировании метилового эфира п-аминобензойной кислоты хлорангидридом п-нитробензойной кислоты в пиридине выходом 98 % получен метиловый эфир 4- (4-нитробензоиламино)бензойной кислоты:
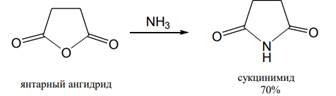
При получении амидов кислот из аммиака и аминов в качестве ацилирующих агентов могут использоваться и ангидриды кислот; при этом из ациклических ангидридов образуются амиды, тогда как циклические ангидриды дают, как правило, имиды кислот:
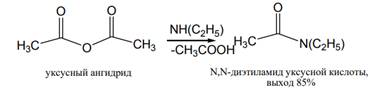
В отличие от условий ацилирования хлорангидридами кислот выделяющуюся при реакции карбоновую кислоту обычно не обязательно связывать избытком амина или другим основанием.
В большинстве случаев реакцию ацилирования аминов целесообразно проводить в растворителях. Таким растворителем при ацетилировании может служить избыток уксусного ангидрида или ледяная уксусная кислота. Во всех случаях можно применять инертные растворители - диэтиловый эфир, бензол, толуол.
Поскольку гидролиз ангидридов карбоновых кислот на холоду протекает медленно, то во многих случаях реакцию можно проводить и в водной среде. Например, при ацетилировании глицина (аминоуксусной кислоты) уксусным ангидридом в воде с выходом 92% получают N-ацетилглицин:
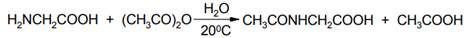
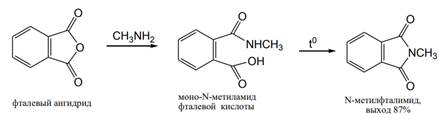
Циклические ангидриды дикарбоновых кислот легко реагируют с аммиаком, первичными и вторичными аминами с раскрытием цикла, образуя моноамиды дикарбоновых кислот. При нагревании этих моноамидов при более высокой температуре или в присутствии водоотнимающих средств они снова претерпевают циклизацию, т. е. переходят в циклические имиды кислот. При проведении реакции с самого начала в достаточно жестких условиях сразу получают циклические имиды:
Дата добавления: 2021-11-16; просмотров: 596;











