Теория атома водорода по Бору.
К началу XX в. основе изучения электрических явлений и радиоактивности считалось доказанным, что:
1) внутри атома заключены электроны;
2) силы взаимодействия атомов и молекул имеют электрическое происхождение;
3) существует сходство в материальной основе атомов такое, что атом одного элемента может превращаться в атом другого элемента.
Оставалось, однако, неясным, какую роль играет во внутреннем строении атома положительное электричество.
Никакая совокупность точечных положительных и отрицательных зарядов, связанных взаимодействием только по закону Кулона, не может ни при каком расположении зарядов оказаться устойчивой системой. Можно доказать в самом общем виде, что если бы при некотором расположении зарядов силы притяжения и отталкивания между всеми зарядами оказались уравновешенными, то малейший сдвиг одного из зарядов уже безвозвратно нарушил бы равновесие.
Учитывая это и стремясь к наибольшей простоте в гипотезе о строении атома, Кельвин в 1902 г. предположил, что положительный заряд атома распределен с равномерной плотностью по объему атома. Расчеты Кельвина показали, что внутриатомные электроны вследствие взаимного отталкивания и притяжения к центру атома должны были бы образовать несколько групп в виде концентрических слоев.
Модель атома Кельвина была видоизменена Томсоном, который, сохранив гипотезу Кельвина о равномерном распределении положительного электричества, предположил, что электроны движутся по орбитам. Томсон показал, что по законам классической электродинамики количество излучаемой электронами энергии должно было бы зависеть от степени урегулированности вращения электронов больше, нежели от их скорости (шесть электронов, движущихся по одной орбите на равных расстояниях один от другого со скоростью в 1/10 скорости света, должны были бы излучать в 6 млн. раз меньше энергии, чем один электрон, движущийся с той же скоростью по той же орбите.). Излучения не было бы совершенно, если бы электроны на орбите были расположены так тесно, что образовали бы непрерывное кольцо отрицательного электричества.
В 1911 г. из опытов Резерфорда обнаружилось, что теория Томсона в самом существенном пункте неверна, а именно ошибочным оказалось предположение, что положительное электричество распределено равномерно по объему атома. На основании результатов этих опытов Резерфордом была предложена ядерная модель атома. Согласно этой модели, в ядре атома – малой по сравнению с объемом всего атома области с линейными размерами 10–15 – 10–14м – сосредоточен весь его положительный заряд и практически вся масса атома. Вокруг ядра в области с линейными размерами ~10–10 м движутся электроны, масса которых составляет лишь весьма малую долю массы ядра. Статическая ядерная модель атома, в которой электроны были бы неподвижны, физически бессмысленна. В результате действия кулоновских сил притяжения электроны сразу же упали бы на ядро. Чтобы этого не произошло, электроны должны двигаться около ядра по орбитам, зависящим от энергии электронов.
Попытка применения классической электродинамики к ядерной модели атома привело к полному противоречию с экспериментальными фактами. Согласно классической теории, должны иметь место:
а) непрерывная потеря электроном энергии в виде излучения электромагнитных волн и неустойчивость атома;
б) существование только непрерывного спектра. Спектральных линий существовать не должно.
В действительности оказывается, что:
а) атом является устойчивой системой;
б) атом излучает энергию лишь при определенных условиях;
в) излучение атома имеет линейчатый спектр.
Правильный вывод из затруднений теории был сделан в 1913 г. датским физиком Нильсом Бором. Бор предположил, что обычные законы электродинамики неприменимы к внутриатомным процессам, и показал, что внутриатомные процессы подчинены законам теории квантов, выдвинутой еще в 1900 г. Планком. К такому заключению Бор пришел, анализируя строение линейчатых спектров.
Линейчатые спектры различных элементов сильно отличаются друг от друга. У большинства металлов число линий в этих спектрах очень велико (у железа, например, более 5000 линий). Рассматривая простейший из атомов – атом водорода, швейцарский физик Бальмер и другие ученые нашли, что частота n, которая соответствует различным линиям водорода, может вычисляться по формуле
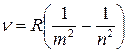 ,
,
где R=3,29×1015с-1 – постоянная Ридберга, m и n – целые числа, причем для данной серии n= m +1, m +2, m +3 и т, д. Для серии Лаймана m=1, для серии Бальмера m =2, для серии Пашена m =3 и т. д. Аналогичные соотношения были найдены и для спектральных линий других элементов.
В основу теории Бора положены три гипотезы, или три постулата, относительно свойств атомов.
Первый постулат Бора (постулат стационарных состояний): существуют некоторые стационарные состояния атома, находясь в которых он не излучает энергии. Этим стационарным состояниям соответствуют вполне определенные (стационарные) орбиты, по которым движутся электроны. При движении по стационарным орбитам электроны, несмотря на наличие у них ускорения, не излучают электромагнитных волн. Энергии стационарных состояний E1, Е2, Е3, ... образуют дискретный спектр.
Второй постулат Бора (правило квантования орбит): в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию
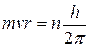 , где n=1; 2; 3; ...
, где n=1; 2; 3; ...
Здесь m – масса электрона, v – скорость электрона, r – радиус его орбиты, h – постоянная Планка.
Третий постулат Бора (правило частот): при переходе атома из одного стационарного состояния Еn в другое состояние Еm испускается или поглощается квант света (фотон), причем
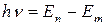 .
.
С помощью данных постулатов нетрудно найти круговые стационарные орбиты водородоподобного атома и соответствующие энергии. В водородоподобном атоме электрон с зарядом е вращается вокруг ядра с зарядом Ze. Масса ядра много больше массы электрона. Поэтому ядро можно считать неподвижным, а электрон – движущимся вокруг ядра по окружности радиуса r.
Центростремительное ускорение электрона создается его кулоновым притяжением к ядру:
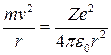 ,
,
отсюда
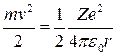 ,
,
т. е. при движении электрона по орбите кинетическая энергия 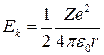 электрона по абсолютной величине равна половине его потенциальной энергии
электрона по абсолютной величине равна половине его потенциальной энергии 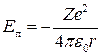 (по знаку эти энергии противоположны, так как потенциальная энергия сил притяжения отрицательна).
(по знаку эти энергии противоположны, так как потенциальная энергия сил притяжения отрицательна).
Последнее уравнение можно переписать в следующем виде:
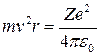 ;
;
сопоставляя это уравнение со вторым постулатом:
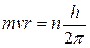 ,
,
получаем простое выражение для скорости vn электрона на n-й стационарной орбите:
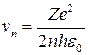
и радиус стационарной орбиты:
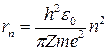 .
.
Радиус первой орбиты (n = 1) в атоме водорода (Z = 1) равен
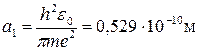
и называется первым боровским радиусом.
Энергия Еn электрона, находящегося на n-й стационарной орбите, равна полной энергии электрона
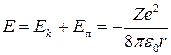 ,
,
где под r следует понимать радиус rn n-й орбиты. Следовательно,
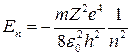 .
.
Эта формула описывает уровни энергии стационарных состояний электрона в водородоподобном атоме. Состояние атома с наименьшей энергией (n = 1) называется основным.
Частота кванта, который излучается при переходе с орбиты n на орбиту m, может быть найдена по формуле:
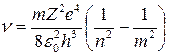 .
.
Дата добавления: 2021-09-25; просмотров: 546;











