Пути репарации ДНК. Репарационные механизмы клетки
Основные типы повреждения ДНК
Все типы повреждений ДНК в облученной клетке можно условно разбить на следующие три группы.
К первой группе принадлежат изменения в каждой из цепей двухспиральной молекулы ДНК, не нарушающие ее пространственную непрерывность как целого. Среди таких повреждений выделяют однонитевые разрывы (ОР), модификации и повреждения оснований, образование щелочелабильных участков и др. Большинство повреждений этого типа образуется вследствие атаки соответствующих участков ДНК радикалами, генерируемыми в среде, т. е. в результате непрямого действия излучений.
Вторую группу образуют повреждения, приводящие к нарушению пространственной и, следовательно, информационной непрерывности двухспиральной молекулы ДНК как целого. К повреждениям этого типа относят двунитевые (двойные) разрывы (ДР), являющиеся следствием образования ОР на противоположных цепях ДНК. При этом расстояние между ОР на противоположных цепях может варьировать от единиц до превышающих десяток нуклеотидных пар.
К третьей группе повреждений ДНК в облученной клетке можно отнести нарушение ее вторичной структуры и надмолекулярной организации, вклад которых в общую картину лучевых повреждений пока еще недостаточно изучен.
Пути репарации ДНК. Репарационные механизмы клетки
Три основных пути репарации: эксцизионная репарация, пострепликативная репарация и предполагаемый механизм репарации двойных разрывов ДНК.
Совершенно очевидно, что ДНК подвержена постоянным повреждениям, вызываемым химическими агентами, УФ- и ионизирующим излучением. Значительная часть энергии клетки расходуется на синтез ферментов для репарации и поддержания постоянства последовательности оснований в ДНК (генетического кода).
Однонитевые разрывы ДНК (ОР).Индуцированные облучением однонитевые разрывы ДНК (ОР) впервые были продемонстрированы с помощью метода "седиментации в щелочном градиенте сахарозы".
Если ДНК подвергли облучению и в ней образовались разрывы, то длина нитей (а следовательно, и молекулярная масса) будет меньше, чем у необлученной, контрольной ДНК. Однонитевые разрывы ДНК можно точно определить при облучении даже в низких дозах К 1 Гр), используя метод щелочной элюции. С увеличением дозы средняя молекулярная масса фрагментов ДНК падает, и по мере уменьшения молекулярной массы все меньше и меньше фрагментов ДНК задерживается фильтром. Показано, что число ОР линейно зависит от дозы облучения в очень широком диапазоне, от менее чем 0,2 до 60 000 Гр. Это означает, что как бы ни была мала доза облучения, должно возникать определенное число ОР. Эффективность образования ОР изменяется в зависимости от многих биохимических факторов, но последние измерения показали, что средняя энергия на 1 разрыв для излучения с низкой ЛПЭ составляет 10-20 эВ.При нормальных условиях значительная часть ОР индуцируется посредством механизма, включающего ОН*-радикалы воды. Это было выяснено при помощи химических соединений, которые называют "ловушками радикалов ОН*. Число ОР, вызванных облучением в оксигенированных клетках млекопитающих, в 3—4 раза превышает число ОР, обнаруживаемых в клетках, облученных в гипоксических условиях.
Репарация происходит по механизму, который называется эксцизионной репарацией.Он состоит в эксцизии (вырезании) части нуклеотидной цепи, содержащей поврежденные звенья ДНК, и использовании комплементарной (неповрежденной) цепи в качестве матрицы для ресинтеза нового отрезка ДНК. Процесс -ферментативный и зависит от температуры; при О °С репарации не происходит. Первая ступень процесса репарации - узнавание места повреждения или разрыва, где фермент эндонуклеаза производит инцизию — "разрез". За инцизией следует полная эксцизия поврежденного участка, а иногда и широкой области прилежащих к нему фрагментов цепи ДНК (осуществляется с помощью экзонуклеазы). Получившаяся брешь застраивается новыми нуклеотидами при помощи ДНК-полимеразы с использованием противоположных неповрежденных нитей в качестве матрицы. Когда эта "репаративная репликация" завершена, новый сегмент ДНК соединяется с интактным участком ДНК при помощи ферментов, незываемых лигазами. В клетках млекопитающих скорость эксцизионной репарации - экспоненциальная: половина радиационных ОР репарируется в течение 15 мин. Поскольку большинство однонитевых разрывов репарируется даже в летально облученных клетках, можно предположить, что ОР не являются причиной, определяющей гибель клеток, в отличие от двунитевых разрывов или поврежденных оснований. Нерепарированные ОР могут несомненно принимать участие в образовании двойных разрывов.
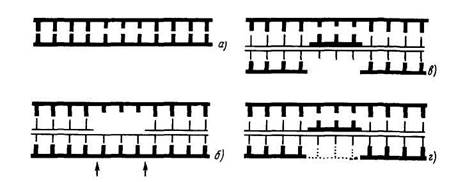
Рис. 1. Общая модель пострепликативной репарации повреждений ДНК, вызванных Уф-излучением: стрелки — инцизия при помощи эндонуклеазы, материнские нити ДНК — толстые линии, вновь синтезированные — тонкие. Пунктирные линии показывают реларативную репликацию. Само повреждение не репарируется, а обходится
Исследованиями, проведёнными на бактериальной ДНК, выявлены три типа репарации одиночных разрывов – сверхбыстрая, быстрая и медленная. Сверхбыстрая завершается в течение 1-2 мин и обеспечивается одной ДНК – лигазой. Быстрая репарация, осуществляемая с помощью ДНК – полимеразы 1, воссоединяет 90 % разрывов, остающихся после сверхбыстрой репарации. Время воссоединения половины разрывов составляет в зависимости от температуры от 1 до 10 мин. Медленная репарация завершается за 40-60 мин, воссоединяя около двух разрывов на каждую цепь ДНК, оставшихся после сверхбыстрой и быстрой репарации
Наряду с разрывами ДНК после облучения возникают множественные повреждения оснований, последние ликвидируются системой эксцизионной репарации, проходящей с помощью репаративного синтеза, который представляет собой многоэтапный процесс типа выщепление – замещение. Вначале повреждение распознаётся специфической гамма – эндонуклеазой, после чего происходит выщепление (инцизия) повреждённого участка вблизи основания, затем – экзонуклеотическая дегидратация повреждённой цепи с захватом смежных неповреждённых нуклеотидов и, наконец, - репаративный синтез в области образовавшегося дефекта при участии ДНК-полимеразы 1 и полинуклеотидлигазы комплементарного участка неповреждённой цепи ДНК в качестве матрицы (шаблона).
В настоящее время мало доказательств того, что пострепликативная репарация играет какую-либо существенную роль в устранении радиационных повреждений ДНК в клетках млекопитающих.
Двойные разрывы ДНК. Двойные разрывы ДНК (ДР) могут быть или результатом единичного события ионизации или следствием совпадения однонитевых разрывов в комплементарных нитях. ДР измеряют при помощи метода седиментации в нейтральном градиенте. При биохимической экстракции в нейтральных условиях не происходит разделения молекулы ДНК на единичные цепи, и число ДР измеряют по уменьшению среднего молекулярного веса фрагментов двунитевой ДНК. Однако эта техника применима для обнаружения разрывов в том случае, если ДНК находится в виде относительно небольших фрагментов (1 — 3 *109 дальтон). Поэтому требуется облучение в довольно больших дозах (50 — 100 Гр), чтобы разбить молекулу ДНК на достаточно мелкие части. Метод седиментации имеет некоторые недостатки при изучении ДНК млекопитающих. Они в основном связаны с тем, что трудно определить истинное количество ДР, поскольку ДНК образует комплексы с мембранами и другими компонентами клетки, что приводит к аномалиям седиментации.
Недавно был предложен другой метод, при помощи которого можно измерить и разрывы ДНК и повреждения оснований. Этот метод "раскручивания" имеет большое значение, так как его можно применять при облучении в гораздо меньших дозах (около 10 Гр), чем при старых методах.
В настоящее время известны два пути репарации ДНК от двунитевых разрывов. Механизм первого из них — сшивание негомологичных концов (поп homologous end joining — NHEJ) связан с первоначальной стабилизацией разорванных концов ДНК Ku-белками и с последующим образованием комплекса между этой структурой и ДНК-зависимой протеинкиназой. Существенно, что при реализации NHEJ-стратегии не происходит движения разорванных концов ДНК в пространстве ядра клетки. При этом координаты ДР относительно фиксированы, а комплексы белков, необходимых для репарации, вероятнее всего мигрируют к месту ДР.
Следует, однако, отметить, что при репарации ДНК по этому механизму возникают нарушения в ее первичной структуре (делеции и др.). Эти нарушения обусловлены тем, что при установлении микрогомологии в районе разрыва остаются свободные концы ДНК, которые затем «отрезаются» при помощи ряда ферментативных реакций.
Второй механизм репарации ДНК от ДР реализуется с помощью гомологичной рекомбинации. Репарация с участием механизма гомологичной рекомбинации подразумевает сближение гомологичных последовательностей в пространстве ядра клетки. Известно также, что часто соответствующие локусы гомологичных хромосом пространственно разобщены. Радиация индуцирует процессы, приводящие к перемещению этих локусов в пространстве ядра клетки, необходимые для их сближения. Последовательности ДНК, от которых информация передается на поврежденную копию, должны быть идентичны на достаточно большой длине (более 200 пар нуклеотидов). Такие рекомбинационные процессы могут реализоваться, например, между материнскими и отцовскими копиями одного и того же гена. Известно, что рекомбинации могут осуществляться также между соответствующими последовательностями ДНК в пределах одной хромосомы.
Соотношения между обоими типами репарации ДНК от ДР зависят от ряда условий, в том числе — от стадии клеточного цикла.
На рис. 2 приведены детали теоретической модели, предложенной Резником, для объяснения возможного механизма репарации ДР ДНК, вызванных облучением. На рис. 2. а показан двойной разрыв ДНК, а на рис. 2. б — ферментативная эксцизия части одной цепи в каждом из разорванных концов, после которой остаются однонитевые участки. Согласно модели, эти однотяжевые нити затем ассоциируются с гомологичными неповрежденными нитями, т. е. происходит рекомбинация таким же путем, как на рис. 2. при пострепликативной репарации.
Неповрежденные цепи "разрезаются" в двух местах при помощи эндонуклеазы. Рекомбинация будет оставлять два небольших и два более крупных однонитевых пробела. Небольшие пробелы могут быть устранены при помощи лигез, а более крупные реперируются путем репаративной репликации. Эти конечные пути репарации покезаны пунктирными линиями на рис. 2. д. Необходимо помнить, что в отличие от эксцизионной и пострепликативной репарации в настоящее время нет экспериментальных доказательств, подтверждаю щих или опровергающих описанные здесь процессы рекомбинации для репарации ДР ДНК.
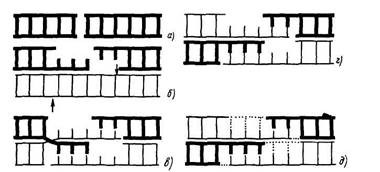
Рис. 2. Предполагаемая модель репарации двунитевых разрывов ДНК: стрелка — инцизия при помощи эндонуклеазы
Повреждение оснований ДНК. Значение радиационных повреждений пуриновых и пиримидиновых оснований ДНК вначале было выяснено на бактериях. В последнее время разработано много чувствительных тестов для определения указанных повреждений, особенно тимина. Эти повреждения линейно зависят от дозы и, вероятно, возникают в результате взаимодействия со свободными радикалами воды ОН*. Радиационно-индуцированные повреждения тиминовых оснований в клетках млекопитающих встречаются чаще, чем однонитевые разрывы ДНК. Механизм эксцизионной репарации, по-видимому, обусловливает быстрое и эффективное удаление поврежденных оснований у бактерий и в клетках млекопитающих. У прокариот нерепарированные повреждения оснований являются важными детерминантами гибели, и имеются доказательства, что подобные повреждения могут играть важную роль для клеток высших животных.
Например, атаксия-телеангиэктазия (AT) - редкое генетическое заболевание человека, встречающееся в 25 случаях на 1 млн новорожденных. Заболевание поражает разные системы организма, включая кожу, нервную и иммунную системы. У 10% пациентов развиваются опухоли в возрасте до 20 лет, в основном лейкемия и болезнь Ходжкина (злокачественный лимфогранулематоз). Интересная особенность больных AT — чрезвычайно высокая радиочувствительность и пониженная способность клеток к репарации потенциально летальных повреждений. Одной из возможных причин повышенной радиочувствительности при этом заболевании является отсутствие репарации некоторых типов повреждений оснований. При AT способность к эксцизионной репарации и воссоединению одно- и двунитевых разрывов ДНК в клетках не нарушена .
Очевидно, что репарация индуцированных химическими агентами или излучением повреждений ДНК — основа для нормального функционирования клетки. Существуют три основных типа репарации. Во-первых, безошибочная репарация, главным образом эксцизионная, не вызывающая в дальнейшем летального исхода или мутаций. Этот тип репарации основан на удалении поврежденного участка ДНК и замене его неповрежденными нуклеотидами, что приводит к восстановлению нормальной функции ДНК. Во-вторых, ошибочная репарация, которая может повлечь за собой нелетальные или летальные мутации. В этом случае не происходит немедленной репарации повреждений, они обходятся во время репликации ДНК, и в дочерних нитях остаются пробелы. Недостающий генетический материал восполняется при пострепликативной стадии репарации путем процесса рекомбинации с материнской нитью ДНК.
И, в-третьих, существует неполная репарация, когда непрерывность нитей ДНК не восстанавливается, и эта "нерепарация" — летальная, но не обязательно мутагенная, по крайней мере у бактерий. Открытие этих разных типов репарации ДНК, а их на самом деле гораздо больше, чем здесь перечислено, оказало большое влияние на радиобиологию в целом, а также на исследования в области генетики и онкологии, о чем пойдет речь ниже.
Многие радиационные повреждения репарируются. Феномен пострадиационного восстановления обусловлен тем, что при облучении в клетках, среди прочих, возникают и такие повреждения, которые обычно приводят клетку к гибели, но при определённых условиях могут быть устранены системами ферментативной репарации. Такие повреждения принято называть потенциальными. Их дальнейшая судьба после возникновения двоякая: либо они репарируются, и тогда клетка выживает, либо реализуются, и тогда она погибнет.
Термин потенциальное повреждение – чисто формальное, феноменологическое понятие, так как не определяет какое-либо конкретное повреждение, а потому может применяться к любому виду радиационных повреждений. В отношении репродуктивной гибели клеток наиболее изучены два вида потенциальных повреждений – сублетальные и потенциально летальные, различающиеся по способу их выявления.
Сублетальные повреждения выявляются методом фракционированного облучения, а потенциально летальные – по изменению выживаемости клеток под влиянием изменения условий, в которых они находятся в первые часы после облучения. Например, не исключено, что часть двойных разрывов ДНК, образовавшихся при облучении клеток в предсинтетический период, может быть восстановлена за время, оставшееся репликации ДНК, а те из них, что клетка не успела «залечить» до момента синтеза ДНК, становятся летальными и вызывают её гибель, образуя аберрации хромосом. Очевидно, что эффективность репарации, т.е. долю выживших клеток, можно увеличить, если искусственно удлинить период G1.
Основные типы репарации:
По времени осуществления различают дорепликативную, пострепликативную и репликативную репарации.
Дорепликативная репарация (до этапа удвоения ДНК) может происходить путём воссоединения разрывов а также с помощью удаления (эксцизии) повреждённых оснований. В воссоединении одиночных разрывов участвует несколько ферментов. В простейшем случае разрывы могут быть воссоединены лигазой. В других ситуациях требуется полная ферментативная система репарации, включающая специфические эндонуклеазы, экзонуклеазы, ДНК-полимеразу, ДНК-лигазу, а также вспомогательные ферменты, обеспечивающие подготовку концов ДНК для заключительного акта репарации – лигазного воссоединения.
Исследованиями, проведёнными на бактериальной ДНК, выявлены три типа репарации одиночных разрывов – сверхбыстрая, быстрая и медленная. Сверхбыстрая завершается в течение 1-2 мин и обеспечивается одной ДНК – лигазой. Быстрая репарация, осуществляемая с помощью ДНК – полимеразы 1, воссоединяет 90 % разрывов, остающихся после сверхбыстрой репарации. Время воссоединения половины разрывов составляет в зависимости от температуры от 1 до 10 мин. Медленная репарация завершается за 40-60 мин, воссоединяя около двух разрывов на каждую цепь ДНК, оставшихся после сверхбыстрой и быстрой репарации
Наряду с разрывами ДНК после облучения возникают множественные повреждения оснований, последние ликвидируются системой эксцизионной репарации, проходящей с помощью репаративного синтеза, который представляет собой многоэтапный процесс типа выщепление – замещение. Вначале повреждение распознаётся специфической гамма – эндонуклеазой, после чего происходит выщепление (инцизия) повреждённого участка вблизи основания, затем – экзонуклеотическая дегидратация повреждённой цепи с захватом смежных неповреждённых нуклеотидов и, наконец, - репаративный синтез в области образовавшегося дефекта при участии ДНК-полимеразы 1 и полинуклеотидлигазы комплементарного участка неповреждённой цепи ДНК в качестве матрицы (шаблона).
Пострепликативная репарация постулируется на основании того факта, что некоторые клетки млекопитающихся выживают при большой дозе излучения, несмотря на пониженную способность к удалению пиримидиновых димеров. Механизм этого вида репарации точно не изучен, предполагают разные варианты синтеза ДНК на повреждённой матрице.
Репликативная репарация – восстановление ДНК в процессе её репликации. Этот тип репарации осуществляется удалением в ходе репликации повреждений в зоне точки роста цепи либо продолжающейся элонгацией в обход повреждений.
| <== предыдущая лекция | | | следующая лекция ==> |
| Скелет пояса конечностей | | | ТЕОРИИ ПРЯМОГО ДЕЙСТВИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ |
Дата добавления: 2021-09-25; просмотров: 273;











