КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ
СТРОЕНИЕ И СВОЙСТВА МЕТАЛЛОВ
Типы кристаллических решеток. Твердые тела делят на кристаллические и аморфные. Кристаллические тела при нагреве остаются твердыми до определенной температуры (температуры плавления), при которой они переходят в жидкое состояние. Аморфные тела при нагреве размягчаются в большом температурном интервале; сначала они становятся вязкими и лишь затем переходят в жидкое состояние.
Все металлы и их сплавы - тела кристаллические. Металлами называют химические элементы, характерными признаками которых являются непрозрачность, блеск, хорошая электро- и теплопроводность, пластичность, а для многих металлов также способность свариваться. Не потеряло своего научного значения определение металлов, данное более 200 лет назад великим русским ученым М. В. Ломоносовым: "Металлы суть светлые тела, которые ковать можно". Для металлов характерно то, что, вступая в химические реакции с элементами, являющимися неметаллами, они отдают последним свои внешние валентные электроны. Это объясняется тем, что у атомов металла внешние электроны непрочно связаны с его ядром. Металлы имеют на наружных оболочках всего 1 -2 электрона, тогда как у неметаллов таких электронов много (5-8).
Чистые химические элементы металлов (например, железо, медь, алюминий и др.) могут образовывать более сложные вещества, в состав которых могут входить несколько элементов-металлов, часто с примесью заметных количеств элементов-неметаллов. Такие вещества называются металлическими сплавами. Простые вещества, образующие сплав, называют компонентами сплава.
Для описания кристаллической структуры металлов пользуются понятием кристаллической решетки. Кристаллическая решетка- это воображаемая пространственная сетка, в узлах которой располагаются атомы (ионы), образующие металл. Частицы вещества (ионы, атомы), из которых построен кристалл, расположены в определенном геометрическом порядке, который периодически повторяется в пространстве. В отличие от кристаллов в аморфных телах (стекло, пластмассы) атомы располагаются в пространстве беспорядочно, хаотично.
Формирование кристаллической решетки в металле происходит следующим образом. При переходе металла из жидкого в твердое состояние расстояние между атомами сокращается, а силы взаимодействия между ними возрастают. Характер взаимодействия атомов определяется строением их внешних электронных оболочек. При сближении атомов электроны, находящиеся на внешних оболочках теряют связь со своими атомами вследствие отрыва валентного электрона одного атома положительно заряженным ядром другого и т. д. Происходит образование свободных электронов, так как они не принадлежат отдельным атомам. Таким образом, в твердом состоянии металл представляет собой структуру, состоящую из положительно заряженных ионов, омываемых свободными электронами.
Связь в металле осуществляется электростатическими силами. Между ионами и свободными электронами возникают электростатические силы притяжения, которые стягивают ионы. Такую связь между частицами металла называют металлической.
Силы связи в металлах определяются силами отталкивания и силами притяжения между ионами и электронами. Ионы находятся на таком расстоянии один от другого, при котором потенциальная энергия взаимодействия минимальна. В металле ионы располагаются в определенном порядке, образуя кристаллическую решетку. Такое расположение ионов обеспечивает взаимодействие их с валентными электронами, которые связывают ионы в кристаллической решетке.
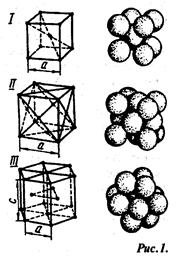 Элементарные ячейки кристаллических решеток:
1 — кубическая объемно-центрированная (а-железо), II— кубическая гранецентрированная (медь), III — гексагональная плотноупакованная; а и с — параметры решеток. Элементарные ячейки кристаллических решеток:
1 — кубическая объемно-центрированная (а-железо), II— кубическая гранецентрированная (медь), III — гексагональная плотноупакованная; а и с — параметры решеток.
|
Типы кристаллических решеток у различных металлов различны. Наиболее часто встречаются решетки: объемно-центрированная кубическая (ОЦК) — α-Fе, Сг, W, гранецентрированная кубическая (ГЦК) — γ-Fе, А1, Сu и гексагональная плотноупакованная (ГПУ) - Мg, Zn и др. Наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме, называют элементарной кристаллической ячейкой (рис. 1). Кристаллическая решетка характеризуется ее параметрами, например длиной ребра куба для ОЦК и ГЦК, которая составляет для металлов 2,8-6 • 10ˆ(-8) см.
Дефекты в кристаллах. В кристаллах всегда имеются дефекты (несовершенства) строения, обусловленные нарушением правильного расположения атомов кристаллической решетки.. 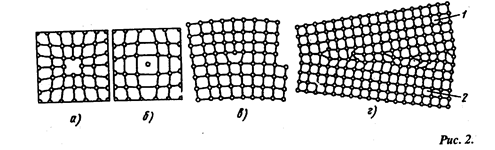
Дефекты в кристаллах:
а — вакансия, б — внедренный атом, в — краевая линейная дислокация, г — неправильное расположение атомов на границе зерен 1 и 2
Дефекты кристаллического строения подразделяют по геометрическим признакам на точечные, линейные и поверхностные. Атомы совершают колебательные движения возле узлов решетки, а с повышением температуры амплитуда этих колебаний увеличивается. Большинство атомов данной кристаллической решетки имеют одинаковую (среднюю) энергию и колеблются при данной температуре с одинаковой амплитудой. Однако отдельные атомы обладают энергией значительно большей средней энергии и перемещаются из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находился такой атом, называется вакансией (рис. 2, а). На это место через некоторое время перемещается один из атомов соседнего слоя и т. д. Таким образом вакансия перемещается в глубь кристалла. С повышением температуры количество вакансий увеличивается и они чаще перемещаются из одного узла в другой. В диффузионных процессах, протекающих в металлах, вакансии играют определяющую роль. К точечным дефектам относят также атом, внедренный в междоузлие кристаллической решетки (рис. 2, б), и замешенный атом, когда место атома одного металла замещается в кристаллической решетке другим, чужеродным атомом. Точечные дефекты вызывают местное искажение кристаллической решетки.
Линейные дефекты являются другим важнейшим видом несовершенства кристаллической решетки, когда в результате сдвига на одно межатомное расстояние одной части решетки относительно другой вдоль какой-либо плоскости число рядов атомов в верхней части решетки на один больше, чем в нижней. В данном случае в верхней части решетки появилась как бы лишняя атомная плоскость (экстра-плоскость). Край экстраплоскости, перпендикулярный направлению сдвига, называется краевой или линейной дислокацией (рис. 2, в), длина которой может достигать многих тысяч межатомных расстояний. Ширина дислокации мала и составляет несколько атомных расстояний.
Кристаллическая решетка в зоне дислокации упруго искажена, поскольку атомы в этой зоне смещены относительно их равновесного состояния. Для дислокации характерна их легкая подвижность. Это объясняется тем, что атомы, образующие дислокацию, стремятся переместиться в равновесное состояние. Дислокации образуются в процессе кристаллизации металлов (см. гл. 1, 2), а также при пластической деформации, термической обработке и других процессах.
Поверхностные дефекты представляют собой границы раздела между отдельными кристаллами(рис. 2, г ).На границе раздела атомы расположены менее правильно, чем в его объеме. Кроме того, по границам раздела скапливаются дислокации и вакансии, а также концентрируются примеси, что еще больше нарушает порядок расположения атомов.При этом сами кристаллы разориентированы, т. е. могут быть повернуты относительно друг друга на десятки градусов. Прочность металла может либо увеличиваться в следствии искажений кристаллической решетки вблизи границ, либо уменьшаться из-за наличия примесей и концентрации дефектов. Дефекты в кристаллах существенно влияют на свойства металлов.
Анизотропия кристаллов. Неодинаковость физических свойств среды в разных направлениях называют анизотропией. Анизотропия кристаллов обусловлена различием плотности упаковки атомов в решетке в различных направлениях. Все кристаллы анизотропны, аморфные тела (стекло, смола) изотропны, т. е. имеют одинаковую плотность атомов в различных направлениях.
Анизотропия свойств важна при использовании монокристаллов— одиночных кристаллов, частицы которых расположены единообразно по всему их объему. Монокристаллы имеют правильную кристаллическую огранку (в форме естественных многогранников), анизотропны по механическим, электрическим и другим физическим свойствам. Так, для монокристалла меди предел прочности δв изменяется от 120 до 360 МПа в зависимости от направления приложения нагрузки.
Металлы и сплавы, применяемые в технике, обычно имеют поликристаллическую структуру, т. е. состоят из множества мелких и различно ориентированных кристаллов, не имеющих правильной кристаллической огранки и называемых кристаллитами (или зернами). В каждом зерне поликристалла наблюдается анизотропия. Однако вследствии разнообразной, беспорядочной ориентировки кристаллографических плоскостей в различных зернах поликристалл может иметь одинаковые свойства по разным направлениям и не обнаруживать анизотропию (когда размеры зерен значительно меньше размеров поликристалла и количество их весьма велико). Это обстоятельство во многих случаях позволяет рассматривать поликристаллическое тело как подобное изотропному, несмотря на анизотропию свойств отдельных составляющих его зерен.
КРИСТАЛЛИЗАЦИЯ
Переход из жидкого состояния в твердое (кристаллическое) называют кристаллизацией. Процессы кристаллизации зависят от температуры и протекают во времени, поэтому кривые охлаждения строятся в координатах температура - время (рис. 3). Теоретический, т.е. идеальный, процесс кристаллизации металла без переохлаждения протекает при температуре Тs (рис. 3). При достижении идеальной температуры затвердевания Тs падение температуры прекращается. Это объясняется тем, что перегруппировка атомов при формировании кристаллической решетки идет с выделением тепла (выделяется скрытая теплота кристаллизации). Каждый чистый металл (не сплав) кристаллизуется при строго индивидуальной постоянной температуре. По окончании затвердевания металла температура его снова понижается.
Практически кристаллизация протекает при более низкой температуре, т.е. при переохлаждении металла до температур Тn, Тn1, Тn2, (например, кривые 1,2). Степень переохлаждения (ΔТ=Тs-Тn) зависит от природы и чистоты металла и скорости охлаждения. Чем чище жидкий металл, тем он более склонен к переохлаждению. При увеличении скорости охлаждения степень переохлаждения возрастает, а зерна металла становятся мельче, что улучшает его качество. Для большинства металлов степень переохлаждения при кристаллизации в производственных условиях составляет от 10 до 30°С. При больших скоростях охлаждения она может достигать сотен градусов.
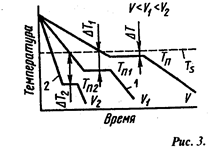
|
Кривые кристаллизации металла при охлаждении с разной скоростью
Процесс кристализации состоит из двух стадий: зарождения кристаллов (зародышей или центров кристаллизации) и роста кристаллов из этих центров. При переохлаждении сплава ниже Тп на многих участках жидкого металла (рис. 4, а, б) образуются способные к росту кристаллические зародыши. Сначала образовавшиеся кристаллы растут свободно и имеют более или менее правильную геометрическую форму (рис. 4, в, г, д). Затем при соприкосновении растущих кристалов их правильная форма нарушается, так как в этих участках рост граней прекращается. 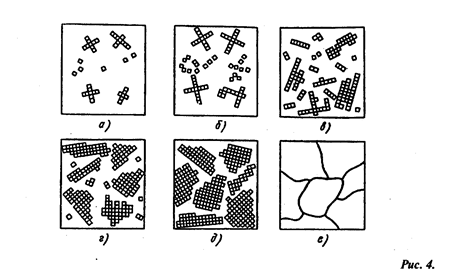
Последовательные этапы процесса кристаллизации металла
Рост кристалла продолжается только в тех направлениях, где есть свободный доступ жидкого металла. В результате кристаллы, имевшие сначала геометрически правильную форму, после затвердевания получают неправильную форму, их называют кристаллитами или зернами (рис.4, е).
Величина зерен зависит от числа центров кристаллизации и скорости роста кристаллов. Чем больше центров кристаллизации, тем мельче зерно металла.
Величина зерен, образующихся при кристаллизации, зависит не только от количества самопроизвольно зарождающихся центров кристаллизации, но также и от количества нерастворимых примесей, всегда имеющихся в жидком металле. Такие нерастворимые примеси являются готовыми центрами кристаллизации. Ими являются оксиды (например, Аl2O3,), нитриды, сульфиды и другие соединения. Центрами кристаллизации в данном металле или сплаве могут быть только такие твердые частицы, которые соизмеримы с размерами атомов основного металла. Кристаллическая решетка таких твердых частиц должна быть близка по своему строению и параметрам решетке кристаллизующегося металла. Чем больше таких частичек, тем мельче будут зерна закристаллизовавшегося металла.
На образование центров кристаллизации влияет и скорость охлаждения. Чем выше скорость охлаждения, тем больше возникает центров кристаллизации и, следовательно, мельче зерно металла Схема дендритного роста кристалла
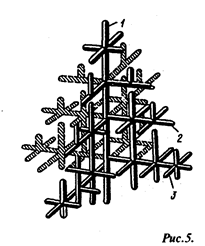
Чтобы получить мелкое зерно, создают искусственные центры кристаллизации. Для этого в расплавленный металл .(расплав) вводят специальные вещества,называемые модификаторами.Так, при модифицировании магниевых сплавов зерно уменьшается от 0,2—0,3 до 0,01-0,02 мм, т.е. в 15-20 раз. Модифицирование отливок проводят введением в расплав добавок, которые образуют тугоплавкие соединения (карбиды, оксиды). При модифицировании, например, стали применяют алюминий, титан, ванадий; алюминиевых сплавов — марганец, титан, ванадий.
Иногда в качестве модификаторов применяют поверхностно-активные вещества. Они растворяются в жидком металле. Эти модификаторы осаждаются на поверхности растущих кристаллов, образуя очень тонкий слой. Этот слой препятствует дальнейшему росту кристаллов, придавая металлу мелкозернистое строение.
Строение металлического слитка. Форма растущих кристаллов определяется не только условиями их касания друг с другом, но и составом сплава, наличием примесей и режимом охлаждения. Обычно механизм образования кристаллов носит дендритный (древовидный) характер (рис. 5). Дендритная кристаллизация характеризуется тем, что рост зародышей происходит с неравномерной скоростью. После образования зародышей их развитие идет в тех плоскостях и направлениях решетки, которые имеют наибольшую плотность у паковки атомов и минимальное расстояние между ними. В этих направлениях образуются длинные ветви будущего кристалла — так называемые оси (1) первого порядка (рис. 5). В дальнейшем от осей первого порядка начинают расти новые оси (2) — оси второго порядка, от осей второго порядка- оси (3) - третьего порядка и т.д. По мере кристаллизации образуются оси более высокого порядка, которые постепенно заполняют все промежутки, ранее занятые жидким металлом.
Рассмотрим реальный процесс получения стального слитка. Стальные слитки получают охлаждением в металлических формах (изложницах) или на установках непрерывной разливки. В изложнице сталь не может затвердеть одновременно во всем объеме из-за невозможности создания равномерной скорости отвода тепла. Поэтому процесс кристаллизации стали начинается у холодных стенок и дна изложницы, а затем распространяется внутрь жидкого металла.
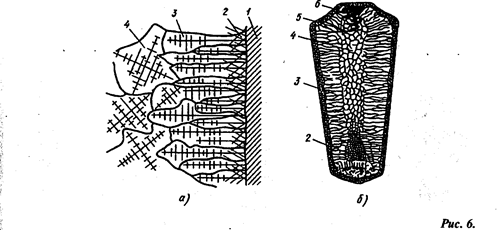
Схема строения стального слитка:
а - расположение дендритов в наружных частях слитка, б - строение слитка; 1 — стенки изложницы, 2 - мелкие равноосные кристаллы, 3 ~ древовидные кристаллы, 4 - равноосные неориентированные кристаллы больших размеров, 5 - усадочная рыхлость, 6 — усадочная раковина
При соприкосновении жидкого металла со стенками изложницы 1 (рис. 6) в начальный момент образуется зона мелких равноосные кристаллов 2. Так как объем твердого металла меньше жидкого, между стенкой изложницы и застывшим металлом образуется воздушная прослойка и сама стенка нагревается от соприкосновения с металлом. Поэтому скорость охлаждения металла снижается, и кристаллы растут в направлении отвода теплоты. При этом образуется зона 3, Состоящая из древовидных или столбчатых кристаллов. Во внутренней зоне слитка 4 образуются равноосные, неориентированные кристаллы больших размеров в результате замедленного охлаждения.
В верхней части слитка, которая затвердевает в последнюю очередь, образуется усадочная раковина 6 вследствие уменьшения объема металла при охлаждении. Под усадочной раковиной металл в зоне 5 получается рыхлым из-за большого количества усадочных пор. Для получения изделий используют только часть слитка, удаляя усадочную раковину и рыхлый металл слитка для последующего переплава.
Слиток имеет неоднородный химический состав, который тем больше, чем крупнее слиток. Например, в стальном слитке концентрация серы и фосфора увеличивается от поверхности к центру и снизу вверх. Химическую неоднородность по отдельным зонам слитка называют зональной ликвацией. Она отрицательно влияет на механические свойства металла.
Аллотропия металлов. Аллотропией, или полиморфизмом, называют способность металла в твердом состоянии иметь различные, кристаллические формы. Процесс перехода из одной кристаллической формы в другую называют аллотропическим превращением. При нагреве чистого металла такое превращение сопровождается поглощением тепла и происходит при постоянной температуре, что связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки. Аллотропические превращения имеют многие металлы: железо, олово, титан и др. Например, железо в интервале температур 911—1392°С имеет гранецентрированную кубическую решетку (ГКЦ) γ-Fе (рис.7). В интерпалах до 911˚С и от 1392 до 1539˚С железо имеет объемно-центрированную кубическую решетку (ОЦК) — α-Fе. Аллотропические формы металла обозначаются буквами α, β, γ и т. д. Существующая при самой низкой температуре аллотропическая форма металла обозначается через букву а, которая в виде индекса добавляется к символу химического элемента металла и т. д.
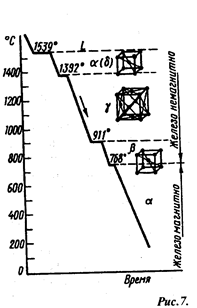 |
Аллотропические превращения в железе.
При аллотропических превращениях происходит изменение свойств металлов — изменение объема металлов (особенно характерно для олова) и растворимости углерода (характерно для железа).
Методы изучения строения металлов. Изучение строения металлов и сплавов производится методами макро- и микроанализа, рентгеновского, а также дефектоскопии (рентгеновской, магнитной, ультразвуковой). Методом макроанализа изучается макроструктура, т.е. структура, видимая невооруженным глазом или с помощью лупы, при этом выявляются крупные дефекты: трещины, усадочные раковины, газовые пузыри и т. д., а также неравномерность распределения примесей в металле. Макроструктуру определяют по изломам металла, по макрошлифам. Макрошлиф — это образец металла или сплава, одна из сторон которого отшлифована, тщательно обезжирена, протравлена и рассматривается с помощью лупы с увеличением в 5—10х.
Микроанализ выявляет структуру металла или сплава по микрошлифам, приготовленным так же, как и для макроанализа, но дополнительно отполированным до зеркального блеска. Шлифы рассматриваются в отраженном свете под оптическим микроскопом при увеличении до 3000х . Из-за различной ориентировки зерен металла они травятся не в одинаковой степени и под микроскопом свет также отражается неодинаково. Границы зерен, благодаря примесям, травятся сильнее, чем основной металл, и выявляются более рельефно. В сплаве структурные составляющие травятся также различно.
В электронном микроскопе рассматривают реплику — слепок с особо тонкой структуры металла при увеличениях до 100 000х. Этот важнейший анализ определяет размеры и форму зерен, структурные составляющие, неметаллические включения и их характер — трещины, пористость и т. д., качество термической обработки. Зная микроструктуру, можно объяснить причины изменения свойств металла.
С помощью рентгеновского анализа изучают атомную структуру металлов, типы и параметры кристаллических решеток, а также дефекты, лежащие в глубине. Этот анализ, основанный на дифракции рентгеновских лучей рядами атомов кристаллической решетки, позволяет обнаружить дефекты (пористость, трещины, газовые пузыри, шлаковые включения и т. д.), не разрушая металла. В местах дефектов рентгеновские лучи поглощаются меньше, чем в сплошном металле, и поэтому на фотопленке такие лучи образуют темные пятна, соответствующие форме дефекта.
Для исследования структуры металла и дефектов изделий широко применяют гамма-лучи, которые проникают в изделие набольшую глубину, чем рентгеновские.
Магнитным методом исследуют дефекты в магнитных металлах (сталь, никель и др.) на глубине до 2 мм (трещины различного происхождения, неметаллические включения и т. д.). Для этого испытуемое изделие намагничивают, покрывают его поверхность порошком железа; осматривают его поверхность и размагничивают изделие. Вокруг дефекта образуется неоднородное поле, вследствие чего магнитный порошок повторяет очертания дефекта. Другой метод - магнитный индукционный -часто используют для оценки полноты структурных превращений в сплавах (изделиях) после их термической обработки.
Ультразвуковым методом осуществляется эффективный контроль качества металла изделий и заготовок практически любых размеров. В импульсных ультразвуковых дефектоскопах ультразвуковая волна от щупа-излучателя распространяется в контролируемом изделии и при встрече с каким-либо дефектом отражается от него. При этом отраженные волны принимаются, усиливаются и передаются на показывающий индикатор. Ультразвук используют для контроля качества роторов, рельсов, поковок, проката и других изделий при необходимости сохранения целостности изделий.
3. ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Физические свойства. К физическим свойствам металлов относят цвет, плотность, температуру плавления, теплопроводность, тепловое расширение, теплоемкость, электропроводность, магнитные свойства и др.
Цветом называют способность металлов отражать световое излучение с определенной длиной волны. Например, медь имеет розово-красный цвет, алюминий - серебристо-белый.
Плотность металла характеризуется его массой, заключенной в единице объема. По плотности все металлы делят на легкие (менее 4500кг/м1) и тяжелые. Плотность имеет большое значение при создании различных изделий. Например, в самолето- и ракетостроении стремятся использовать более легкие металлы и сплавы (алюминиевые, магниевые, титановые), что способствует снижению массы изделий.
Температурой плавления называют температуру, при которой металл переходит из твердого состояния в жидкое. По температуре плавления различают тугоплавкие металлы (вольфрам 3416°С, тантал 2950°С, титан 1725°С и др.) и легкоплавкие (олово 232°С, свинец 327°С, цинк 419,5°С, алюминий 660°С). Температура плавления имеет большое значение при выборе металлов для изготовления литых изделий, сварных и паяных соединений, термоэлектрических приборов и других изделий. В системе СИ температуру плавления выражают в градусах Кельвина (К).
Теплопроводностью называют способность металлов передавать тепло от более нагретых к менее нагретым участкам тела. Серебро, медь, алюминий обладают большой теплопроводностью. Железо имеет теплопроводность примерно в три раза меньше, чем алюминий, и в пять раз меньше, чем медь. Теплопроводность имеет большое значение при выборе металла для деталей. Например, если металл плохо проводит тепло, то при нагреве и быстром охлаждении (термическая обработка, сварка) в нем образуются трещины. Некоторые детали машин (поршни двигателей, лопатки турбин) должны быть изготовлены из материалов с хорошей теплопроводностью. В системе СИ теплопроводность имеет размерность Вт/ (м • К).
Тепловым расширением называют способность металлов увеличиваться в размерах при нагревании и уменьшаться при охлаждении. Тепловое расширение характеризуется коэффициентом линейного расширения α =(l2-l1)/[l1(t2-t1)], где l1 и l2 длины тела при температурах t1 и t2. Коэффициент объемного расширения равен 3α. Тепловые расширения должны учитываться при сварке, ковке и горячей объемной штамповке, изготовлении литейных форм, штампов, прокатных валков, калибров, выполнении точных соединений и сборке приборов, при строительстве мостовых ферм, укладке железнодорожных рельсов.
Теплоемкостью называют способность металла при нагревании поглощать определенное количество тепла. В системе СИ имеет размерность Дж/К. Теплоемкость различных металлов сравнивают по величине удельной теплоемкости — количеству тепла, выраженному в больших калориях, которое требуется для повышения температуры 1 кг металла на 1°С (в системе СИ — Дж/(кгК)).
Способность металлов проводить электрический ток оценивают двумя взаимно противоположными характеристиками —электропроводимостью и электросопротивлением. Электрическая проводимость оценивается в системе СИ в сименсах (См), а удельная электропроводимость—в См/м, аналогично электросопротивление выражают в омах (Ом), а удельное электросопротивление - в Ом/м. Хорошая электропроводимость необходима, например, для токонесущих проводов (медь, алюминий). При изготовлении электронагревательных приборов и печей необходимы сплавы с высоким электросопротивлением (нихром, константан, манганин). С повышением температуры металла его электропроводимость уменьшается, а с понижением — увеличивается.
Магнитные свойства характеризуются абсолютной магнитной проницаемостью или магнитной постоянной, т. е. способностью металлов намагничиваться. В системе СИ магнитная постоянная имеет размерность Гн/м. Высокими магнитными свойствами обладают железо, никель, кобальт и их сплавы, называемые ферромагнитными. Материалы с магнитными свойствами применяют в электротехнической аппаратуре и для изготовления магнитов.
Химические свойства. Химические свойства характеризуют способность металлов и сплавов сопротивляться окислению или вступать в соединение с различными веществами: кислородом воздуха, растворами кислот, щелочей и др. Чем легче металл вступает в соединение с другими элементами, тем быстрее он разрушается. Химическое разрушение металлов под действием на их поверхность внешней агрессивной среды называют коррозией.
Металлы, стойкие к окислению при сильном нагреве, называют жаростойкими или окалиностойкими. Такие металлы применяют для изготовления деталей, которые эксплуатируются в зоне высоких температур.
Сопротивление металлов коррозии, окалинообразованию и растворению определяют по изменению массы испытуемых образцов на единицу поверхности за единицу времени.
Химические свойства металлов обязательно учитываются при изготовлении тех или иных изделий. Особенно это относится к изделиям или деталям, работающим в химически агрессивных средах.
Дата добавления: 2017-06-13; просмотров: 3755;











