ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ
Если рассматривать равновесие «малорастворимый электролит ⇄ насыщенный водный раствор электролита», иначе
KmАn ⇄ mKn+ + nAm– ,
то можно записать выражение для константы равновесия K
K = 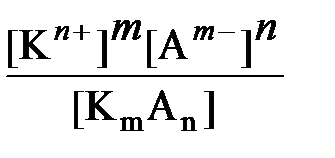
или [Kn+]m[Am–]n = K[KmAn].
Так как концентрация твердого компонента [KmAn] постоянна, то произведение K[KmAn].является величиной постоянной. Обозначив эту величину буквами ПР (произведение растворимости), получим выражение
ПР =[Kn+]m[Am–]n.
В насыщенном растворе малорастворимого электролита произведение концентраций (активностей) ионов в степени их стехиометрических коэффициентов является при данной температуре величиной постоянной.
С повышением температуры произведение растворимости ПРобычно растет.
Численное значение произведения растворимости ПР можно рассчитать, зная растворимость малорастворимого электролита.
Пример 2. Определим произведение растворимости ПР хлорида серебра AgCl, если растворимость AgCl в воде составляет
(в нормальных условиях) 1,3×10-5 моль/л.
Определяем концентрацию катионов и анионов. В соответствии с состоянием равновесия
AgCl ⇄ Ag+ + Cl–
[Ag+][Cl–] = 1,3×10–5 моль/л. По уравнению (78) получаем
ПР = (1,3×10–5)2 = 1,69×10–10.
Пример 3. Определим ПР гидроксида алюминия Al(OH)3, если его растворимость составляет 2,9×10–9 моль/л.
Определяем концентрацию катионов и анионов. В соответствии с состоянием равновесия
Al(OH)3 ⇄ Al 3+ + 3ОН–
на каждый ион Al 3+ приходится три гидроксид-иона ОН–, поэтому концентрация катионов Al 3+ составляет 2,9×10–9 моль/л, концентрация анионов ОН– – 8,7×10–9 моль/л.
ПР = 2,9×10–9 · (8,7×10–9)3 = 1,91×10–33
Произведение растворимости имеет широкое применение при определении условий полноты осаждения соединений. Труднорастворимый электролит выпадает в осадок, если произведение концентраций (активностей) его ионов в растворе превысит значение ПР.
Например, доливая к раствору сульфата кальция CaSO4, где
ПР = 2,3×10–4, электролит, содержащий ионы SO42–, мы достигаем
ПР >2,3×10–4, т. е. образуется пересыщенный раствор и из него может выпадать осадок CaSO4.
Пример 4.Определите, выпадет ли осадок при сливании равных объемов 0,01 н. растворов HCl и AgNO3. Произведение растворимости хлорида серебра ПР = 1,69×10–10.
Концентрация ионов после сливания двух растворов равных объемов будет составлять по 0,01/2=0,005 моль/л каждого.
Фактическое произведение растворимости составляет
ПРфакт = (0,005)2 = 2,5×10–5×
Мы видим, что ПРфакт >> ПР, следовательно, осадок будет активно выпадать.
Дата добавления: 2019-12-09; просмотров: 312;










