Удаление из воды сероводорода
Наличие в воде сероводорода придает ей очень неприятный запах и часто препятствует использованию такой воды для хозяйственно-питьевого и промышленного водоснабжения.
Вдыхание сероводорода, выделившегося из воды в воздух, может привести к ухудшению памяти, катару верхних дыхательных путей, бронхиту, фурункулезу и конъюнктивиту.
Присутствие в воздухе 0,8 мг/л сероводорода может стать причиной отравления со смертельным исходом.
В воде, содержащей сероводород, разрушается цемент вследствие образования растворимого гидросульфида кальция Са(НS)2 и выходят из строя раструбные соединения труб и бетонные сооружения.
Вследствие образования гальванических пар сульфида железа с железом, из которого изготовлены трубы, происходит интенсивная коррозия металлических трубопроводов.
В природной воде сернистые соединения находятся в виде молекулярно растворенного в воде сероводорода Н2S, гидросульфид-иона НS- и сульфид-иона S2-. При одновременном присутствии в воде сульфид-ионов и железа образуется черная тонкодисперсная взвесь сульфида железа.
Содержание различных форм сернистых соединений в воде, диссоциированных согласно приведенным ниже уравнениям, определяется по константам диссоциации сероводородной кислоты первой и второй ступени.
S2-+H-«HS-; 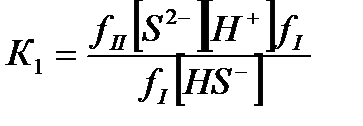
HS-+H-«H2S-; 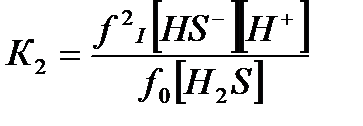
где: f – коэффициенты активности ионов соответствующе валентности;
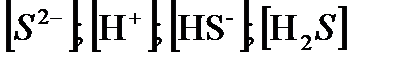 - концентрации соответствующих ионов и сероводорода
- концентрации соответствующих ионов и сероводорода
В практике технологии очистки воды содержание сероводорода обычно определяют прямым йодометрическим титрованием в кислой среде
Таблица 12
Концентрация сернистых соединений (в долях единицы), соответствующая различным значениям рН воды
| рН | S2- | HS- | H2S |
| 10-10 | 10-2 | ||
| 10-8 | 10-1 | 0.9 | |
| 10-6 | 0.5 | 0.5 | |
| 10-5 | 0.9 | 0.1 |
В зависимости от формы существования сернистых соединений в подземной воде методы очистки от сероводорода могут быть разделены на четыре группы:
- физические, в которых удаление сероводорода осуществляют аэрацией воды;
- химические, в которых применяют окисление сероводорода хлором или другими реагентами, а также удаление сероводорода при помощи гидрата окиси железа или окислительно-восстановительных ионитов;
- физико-химические, в которых подкислением воды переводят все сернистые соединения в молекулярно-растворенную форму, а затем удаляют аэрацией;
- биохимические, в которых сернистые соединения окисляются серобактериями.
Удаление из воды сероводорода аэрацией. Сущность этого способа заключается в выделении газа из воды в воздух вследствие более низкого парциального давления его в воздухе, чем в воде, содержащей сероводород.
Аэрационные установки, применяемые в технологии очистки природных и сточных вод, можно разделить на два типа:
- установки вытеснения. К этому типу относятся противоточные дегазаторы (градирни), получившие большое распространение в технологии очистки природных вод. Вода в них подается сверху, а воздух - снизу. Аэрация воды в этих установках происходит практически мгновенно;
- установки с длительной аэрацией, основанные на принципе перемешивания воды: пневматические, механические и пневмомеханические.
В установках с пневматической аэрацией осуществляется барботаж воздуха через воду с помощью распределительной системы. В зависимости от способа распределения воздуха в резервуаре аэрирование производится мелкими пузырями (d=1-5 мм), средними (d= 5... 0 мм) и крупными (d>10 мм).
Вопрос об очистке воздуха, удаляемого из дегазаторов в атмосферу, от сероводорода следует в каждом конкретном случае согласовывать с органами Государственного санитарного надзора.
При значительном содержании в воде сероводорода может применяться следующая схема обработки воды:
- подкисление серной или соляной кислотой до рН = 5;
- аэрация на вентиляторной градирне;
- обработка хлором для окисления оставшегося в воде после аэрации сероводорода;
- обработка коагулянтом и фильтрование для очистки воды от образующейся в процессе аэрации и хлорирования коллоидной серы.
Доза хлора для обработки воды после аэрации составляет 4—5 мг/л, доза коагулянта для очистки воды от образующейся коллоидной серы — 25 мг/л в пересчете на А12(SО4)3. После коагуляции вода фильтруется на скорых песчаных фильтрах.
Для устранения коррозионных свойств и для улучшения процесса коагуляции воду перед введением коагулянта подщелачивают известью или содой.
При аэрации воды происходят следующие взаимно противоположные процессы. Одновременно с удалением сероводорода из воды удаляется также свободная двуокись углерода и рН воды повышается. Следовательно, равновесие сернистых соединений должно сдвигаться вправо и концентрация молекулярно растворенного в воде сероводорода должна понижаться.
При наличии в воде сернистых соединений концентрация молекулярно растворенного сероводорода не должна быть менее определяемой значением рН воды. Поэтому при удалении сероводорода часть сернистых соединений превращается в молекулярно растворенный сероводород, и равновесие химической реакции Н2S«НS- + S2-сдвигается влево.
В тех случаях, когда удаление из воды сероводорода происходит в результате массообмена, т.е. при рН=6, противоточные дегазаторы мгновенного действия оказываются выгоднее длительной аэрации. Как показали результаты исследований установок с длительной аэрацией при рН=7, часть сульфидов переходит в сероводород, который удаляется аэрацией, в результате чего удаляются также гидросульфид-ионы.
Окисление сероводорода кислородом воздух. Снижение в воде содержания сероводорода может быть результатом окисления его кислородом воздуха, растворенным в воде.
По стадиям реакции окисления, можно представить следующим образом:
2Н2S+О2 →2S¯ + 2Н20;
2S + 4О2→2SO42-;
2HS- + 2O2 =S2O32- + Н20
2S2O32- + 3O2 →4SO32-;
2SO32- + O2 →2SO42-
По стехиометрическому соотношению на 1 мг Н2S требуется 2,25—2,5мг кислорода.
Реагентные методы очистки воды от сероводорода. При небольшом содержании в воде сероводорода для очистки воды применяют хлорирование. При расходе хлора 2,1 мг на 1 мг сероводорода последний окисляется до серы по реакции:
Н2S+Cl2 →S¯ + 2Н20
В результате реакции образуется взвесь в количестве, эквивалентном содержанию сероводорода (или гидросульфидов). При расходе хлора 8,4 мг на 1 мг сероводорода основным продуктом реакции являются сульфаты:
Н2S + 4С12+4Н2О=Н2SО4+8НС1;
Следует отметить, что даже при большом избытке хлора в опытах образовывалось не менее 0,2 мг взвеси на 1 мг сероводорода.
Для окисления сульфидных соединений применяется также перманганат калия. Особенно этот метод эффективен при предварительном подкислении и аэрации.
Технология окисления сероводорода, растворенного в воде, озоном была разработана в Новочеркасском политехническом институте. При расходе озона, равном 0,5 мг на 1 мг сероводорода, процесс окисления сероводорода заканчивается образованием коллоидного раствора элементарной серы по реакции:
3Н2S + O3 = 3S¯ + ЗН20
При расходе озона, равном 1,87 мг на 1 мг сероводорода, процесс окисления сероводорода заканчивается образованием сульфатов:
3Н2S + 4О3 = ЗН2SО4.
Для воды, содержащей 15—20 мг/л сероводорода, продолжительность озонирования составляет 20 мин, расчетный расход озона равен 30 мг/л. В некоторых случаях вода приобретает легкую опалесценцию, что вызывает необходимость ее осветления и обесцвечивания.
Биохимическое окисление сероводорода серными бактериями. Процесс утилизации сероводорода в результате жизнедеятельности микроорганизмов имеет ряд особенностей.
1. Сероводород и сульфиды являются основным субстратом для окислительной деятельности серных бактерий. Кроме того, необходимо наличие в воде также биогенных веществ: азота, фосфора, калия. В ряде случаев микроорганизмы хуже развиваются при отсутствии некоторых из следующих микроэлементов: железа, магния, цинка, меди, молибдена, бора, марганца, кобальта.
Добавка совершенно незначительного количества (порядка сотых и даже тысячных долей мг/л) некоторых из этих микроэлементов иногда сильно интенсифицирует развитие серных и тионовых бактерий.
В результате окисления сероводорода внутри клеток (серобактерий) или вне клеток (тиобактерии) откладывается сера, играющая роль запасного питательного вещества, которое расходуется бактериями при недостатке основного субстрата. Конечным результатом биохимического процесса окисления сернистых соединений! является образование сульфатов.
Для серных бактерий углекислота является единственным источником углерода. Все виды серных бактерий, встречающихся в природных водах, за исключением Тhiobacillus denitrificans развиваются только в аэробных условиях. Последний вид бактерий может окислять соединения серы только в присутствии нитратов.
Выбор метода удаления сероводорода из воды определяется многими факторами. В первую очередь – химсоставом воды и производительностью водоочистных сооружений. Особое внимание следует уделять и возможным выбросам в атмосферу Н2S при обработке воды на градирнях или барботажем. На рис. 26 приведена технологическая схема очистки воды с предотвращением выбросов сероводорода в атмосферу.
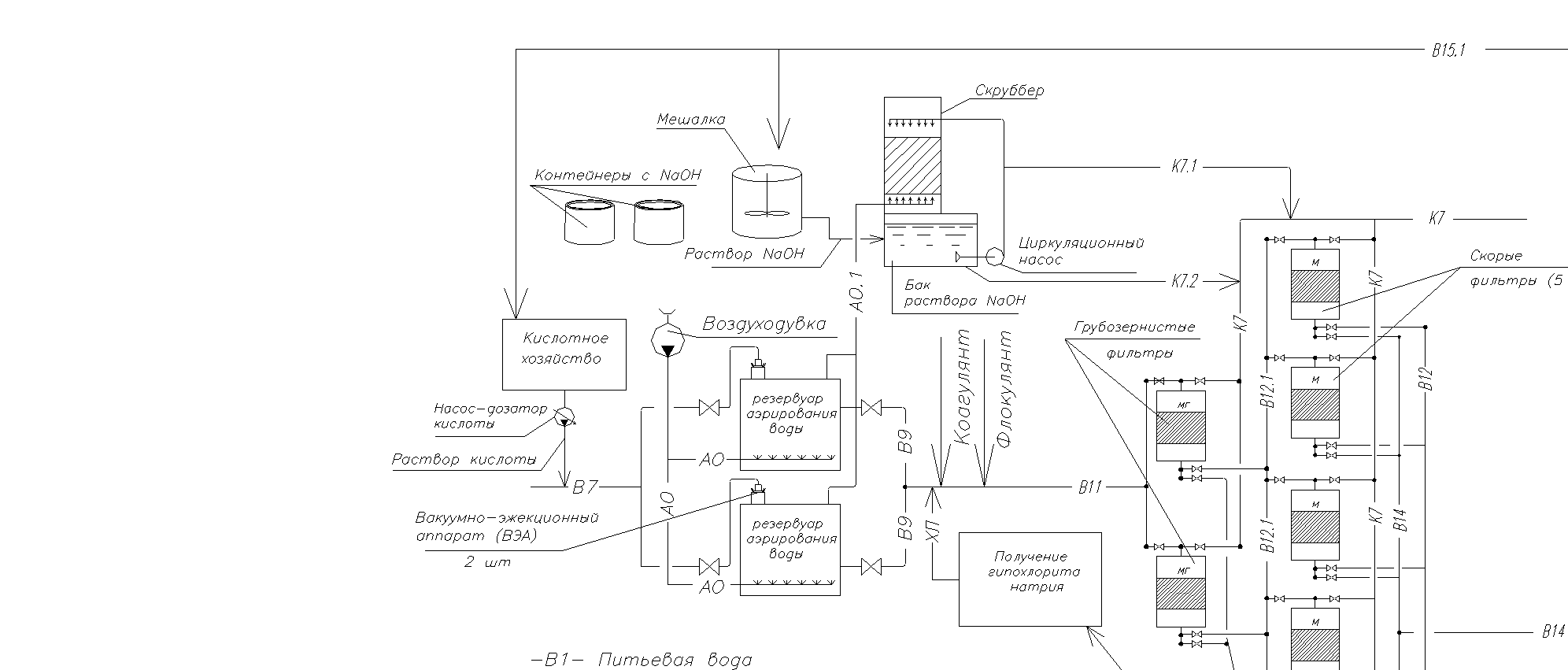
Рисунок 26. технологическая схема очистки воды и воздуха от сероводорода.
Дата добавления: 2021-07-22; просмотров: 668;











