Обескислороживание воды
Кислород из воды можно удалять:
а) химическими методами - введением в воду восстановителей, связывающих растворенный в воде кислород; фильтрованием воды через электроно-обменные смолы и другие нерастворимые в воде гранулированные вещества, способные окисляться растворенным в воде кислородом;
б) физическими методами, основанными на уменьшении растворимости кислорода в воде при ее нагреве или снижении парциального давления кислорода у поверхности воды.
При введении в воду веществ, способных достаточно быстро окисляться растворенным кислородом, последний расходуется на их окисление, и концентрация его в воде снижается. При введении в воду избытка восстановителя содержание растворенного кислорода может быть снижено практически до нуля.
Чаще всего для химического обескислороживания воды применяются сульфит натрия, сернистый газ, тиосульфат натрия, гидразин.
При введении в воду сульфит натрия окисляется растворенным кислородом до сульфата натрия:
2Na2S03 + О2 = 2Na2S04
При добавлении в воду сернистый газ вступает в реакцию с бикарбонатом кальция с образованием сернистокислого кальция, который затем растворенным в воде кислородом окисляется в сульфат кальция:
Если добавить в воду гидросульфит Na2S04 или тиосульфат натрия Na2S03, они окисляются растворенным в воде кислородом до сульфата натрия, при этом плотный остаток воды повышается на меньшую величину, чем при введении в воду сульфита натрия.
Реакция окисления сульфитов и тиосульфатов растворенным в воде кислородом при обычных температурах идет медленно и при температуре воды ниже 5°С и 10%-ном избытке восстановителя заканчивается лишь через 3-4 ч.
Скорость этого процесса может быть значительно увеличена подогревом воды и введением избытка восстановителя или катализатора.
Повышение температуры воды на 10° увеличивает почти в 2 раза скорость реакции. При введении сульфитов в воду, нагретую до температуры 95-100°С, процесс обескислороживанияводы заканчивается через 1-2 мин даже при минимальном против стехиометрического избытке (5%) сульфита. Увеличение дозы сульфита вдвое против стехиометрической увеличивает скорость процесса обескислороживания воды в 4 раза.
Хорошими катализаторами процесса обескислороживания воды сульфитом натрия, сернистым газом, гидросульфитом и тиосульфатом натрия являются соли меди и кобальта, а также окислы марганца.
При обескислороживании воды сульфитом натрия или сернистым газом необходимую дозу реагента, мг/л можно подсчитывать по формуле:
а= 1,1b[02], (26)
где b- теоретический расход реагента на связывание 1 мг растворенного кислорода, принимаемый для безводного сульфита натрия 7,9, для кристаллического сульфита натрия'(Na2SO3-7H2O) 16, для сернистого газа 4;
[О2] - концентрация в воде растворенного кислорода в мг/л.
Медный купорос (2,5 мг/л в пересчете по безводному продукту) или сернокислый кобальт (0,003 мг/л в пересчете по безводному продукту) следует добавлять в воду вместе с введением в нее раствора сульфита натрия или сернистого газа или до введения их.
Последнее время для обескислороживания воды начали применять гидразин N2H4. При введении в воду гидразин окисляется растворенным в ней кислородом с образованием инертного газа (азота) и воды:
N2H4+ 02=2H2O+N2.
На связывание 1 мг О2 теоретически расходуется 1 мг гидразина, однако обычно его дозируют в полуторном избытке. На станции гидразин доставляют в виде 35%-ного водного раствора гидразингидрата (раствор более высокой концентрации огнеопасен). Дозируют гидразин в обрабатываемую воду в виде 0,5-1%-ного раствора, имеющего щелочную реакцию (рН>9). По сравнению с сульфитом натрия гидразин имеет следующие преимущества: он не увеличивает плотного остатка и его расход в 8 раз меньше по весу.
Реакция связывания гидразином растворенного в воде кислорода идет очень быстро при температуре воды 80-100° С. Поэтому гидразин особенно хорошо зарекомендовал себя при дообескислороживании воды, подвергнутой предварительно термической деаэрации.
Удаление растворенного кислорода может быть также достигнуто фильтрованием воды через электронообменные и электроноионообменные смолы, а также стальные стружки.
Электронообменные смолы (ЭО) представляют собой продукты поликонденсации таких восстановителей, как пирогаллола, гидрохинона, пирокатехина или гидразина с фенолом и формальдегидом. Электроноионообменные смолы (ЭЙ) наряду с окислительными и восстановительными обладают и ионообменными свойствами.
При использовании ЭО для обескислороживания воды их регенерация по исчерпании восстановительной способности производится 1-2%-ным раствором тиосульфата или сульфита натрия. Восстановительная способность электронообменных смол, выпускаемых отечественной промышленностью, равна: ЭО-6- 450 мг-экв/л, ЭО-7-600-800 мг-экв/л, ЭО-11-5000 мг-экв/л. Последний представляет собой медную форму сульфокатионита, содержащего координационно связанный гидразин.
Электроноионообменные смолы представляют собой катиониты с введенным в них железом или медью. Электроноионообмен-ная смола ЭЙ-12 имеет обменную способность по кальцию 500 мг-экв/л.
Аниониты, образующие комплексные соединения с медью, после обработки раствором сульфита или аммиаката меди обладают высокой поглотительной способностью по отношению к кислороду (до 5 кг О2 на 1 м3 объема анионита). Такой анионит регенерируют пропуском через него раствора гидросульфита натрия.
Аналогичным образом иониты, способные сорбировать кислород, могут быть приготовлены из обычных товарных катионитов. Для этого катионит в фильтре сначала обрабатывают раствором соли двухвалентного железа или меди. При этом ионы Fe2+ или Сu2+ сорбируются катионитом. При дальнейшей обработке катионита подщелоченным раствором сульфита или гидросульфита натрия на его зернах выпадают гидрозакиси железа или меди. При фильтровании через такой катионит воды гидрозакиси железа или меди поглощают из нее растворенный кислород, окисляясь до соответствующих гидроокисей. Обескислороживающая способность катионита восстанавливается воздействием на него раствора сульфита или гидросульфита натрия.
Обескислороживание горячей умягченной воды может быть достигнуто фильтрованием ее через слой стальных стружек. При этом растворенный в воде кислород расходуется на окисление гидрозакиси железа, образующейся на поверхности стружек.
Мелкую стружку из обычной нелегированной углеродистой стали очищают от грязи и обезжиривают промывкой горячим раствором щелочи и горячей водой, затем активируют в течение 15-30 мин. 2%-ным раствором серной или соляной кислоты, вновь промывают горячей водой и загружают в фильтр (1200кг на 1 м3 фильтрующего слоя).
Фильтрование через такую стружку обеспечивает практически полное удаление кислорода из горячей воды, если она предварительно умягчена и ее жесткость не превышает 0,05 мг-экв/л. При температуре 100°С должна быть обеспечена 1,5-2-мин, а при температуре 75° С - 4-5-мин продолжительность контакта воды со стружкой.
При обескислороживании этим методом холодной или неумягченной воды поверхность стружки быстро пассивируется и обескислороживание воды прекращается.
Во избежание загрязнения воды железом ее после сталестружечного фильтра желательно фильтровать через слой песка.
Электрохимический метод обескислороживания воды, разработанный А. И. Красилыциковым и Л. И. Волчковой, а также О. М. Фаянсом, сводится к пропуску всей или части обескислороживаемой воды через электролизер со стальными биполярными электродами.
В таком электролизере одновременно происходят три процесса:
1) анодное растворение железа на анодах и окисление образовавшейся затем гидрозакиси железа растворенным в воде кислородом в гидроокись
2) катодное восстановление кислорода на катоде;
3) окисление растворенным в воде кислородом водорода, выделившегося на катоде электролизера,
Последний процесс при отсутствии катализаторов идет медленно. Поэтому для его реализации желательно либо вводить катализатор (активный уголь, дробленый пиролюзит) непосредственно в рабочие камеры электролизера, либо пропускать воду с растворенным водородом через фильтр, загруженный гранулированным катализатором.
Для удаления хлопьевидной гидроокиси железа воду после электролизера следует пропускать через фильтры, загруженные песком или мраморной крошкой.
К физическим методам обескислороживания воды относят термическое и вакуумное ее деаэрирование. В обоих случаях удаление из воды кислорода достигается разбрызгиванием ее в условиях, при которых вода кипит. В термических дегазаторах вода разбрызгивается при температуре выше 100°С и давлении, большем атмосферного. В вакуумных деаэраторах поддерживают вакуум, при котором вода кипит при данной ее температуре.
Вакуумные дегазаторы (рис. 25) представляют собой стальные цилиндрические резервуары, заполненные насадкой из колец Рашига или из деревянных реек.
Для того чтобы вода из вакуумного дегазатора стекала в приемный бак, низ дегазатора должен быть расположен примерно на 10 м выше поверхности воды в приемном баке. Для уменьшения высоты расположения дегазатора целесообразно отсасывать из него обескислороженную воду насосом.
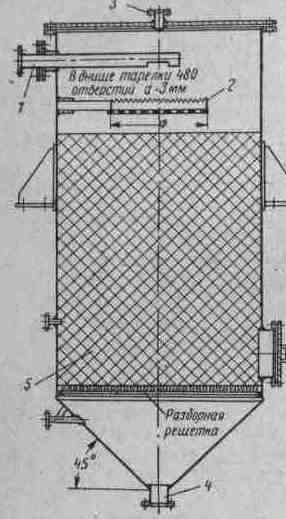
Рисунок 25. Схема вакуумного дегазатора
1 - подвод воды; 2 - распределительная тарелка; 3 - отсос парогазовой смеси; 4 - отвод дегазированной воды; 5 - насадка
Площадь поперечного сечения дегазатора принимают по плотности орошения насадки равной 50 м3/(м2•ч). Площадь поверхности насадки дегазатора F определяют по формуле (23).
Дата добавления: 2021-07-22; просмотров: 600;











