Характеристические функции.
Все характеристические функции являются функциями состояния.
Функция называется характеристической, если её частная производная по некоторому параметру даёт другой параметр, а именно, соответствующий тому, по которому производится дифференцирование.
1. Рассмотрим сопряжение по координатам:
В этом случае, в качестве независимо изменяющихся параметров выступают только координаты, а потенциалы отслеживают их изменение по каким-либо зависимостям.
Как было показано ранее, внутренняя энергия является функцией состояния и полностью определяется всей совокупностью координат состояния системы.
U=U(X1, X2,…, Xn) (17)
Дифференциалы всех функций состояния являются полными дифференциалами, поэтому dU- полный дифференциал. В соответствии с правилами математики нахождение полного дифференциала функции нескольких переменных
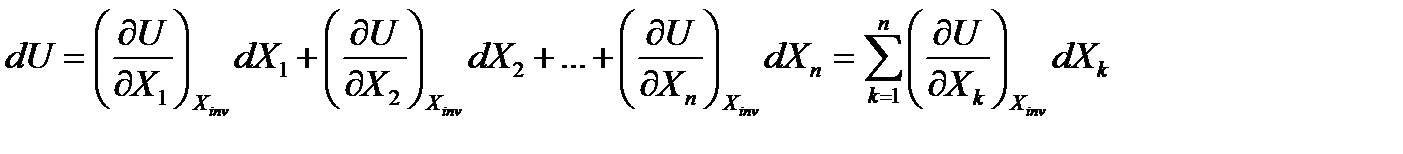
Xinv – означает, что все остальные координаты инвариантны, т.е. не являются переменными (замороженными).
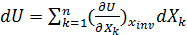 (23)
(23)
Из первого начала термодинамики в общем виде (3) и формулы (23) следует равенство правых частей.
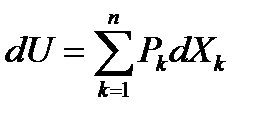 =
= 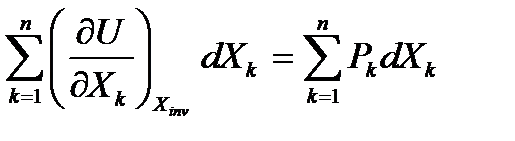
Так как данное равенство должно выполняться при любом k, то получаем
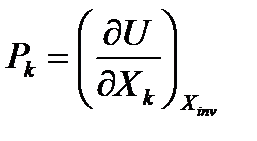 (24)
(24)
Из сравнения полученного выражения формулы (24) и определения характеристической функции следует вывод о том, что внутренняя энергия является характеристической функцией при сопряжении по координатам.
Введем общее обозначение характеристической функции Y(пси).
Y(Xk)=U (25)
Дифференциалом этой характеристической функции является первое начало термодинамики в общем виде.
В качестве примера рассмотрим термодеформационную систему.
| X | S | v |
| P | T | -p |
Y(S,v)=U
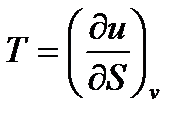 (26)
(26)
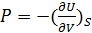 (27)
(27)
Из первого начала термодинамики получается
dU=T dS – p dv (28)
(28)- первое начало термодинамики в обычной форме для термодеформационной системы.
В общем случае (для любой системы) при сопряжении по координатам дифференциальной характеристикой функции определяется по формуле:
dU=dY 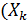 )=
)= 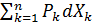
2. Рассмотрим сопряжение по потенциалам:
При этом виде сопряжения независимым образом изменяются только потенциалы, а координаты отслуживают их изменение по каким-либо конкретным формулам, так как изменяются зависимым образом. Вывод аналогичен случаю 1, можно сразу записать итоговую формулу:
1) 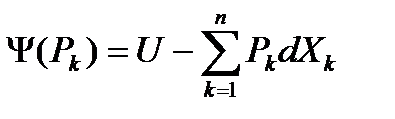 (29)
(29)
2) 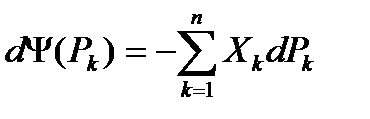 (30)
(30)
3) 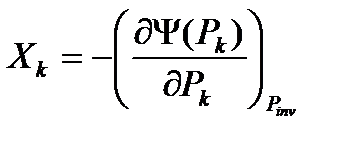 (31)
(31)
Рассмотрим в качестве примера термодеформационную систему:
| X | S | V |
| P | T | -p |
Из (29) =>Y(T,p) = U – TS + pv – эта характеристическая функция в термодинамике имеет обозначение и название
F = U – TS + pv (32)
(32)– свободная энтальпия (удельная свободная энтальпия);
Из (30) => dF = S dT + v dp (33)
По своей сути уравнение (33) это одна из форм первого начала термодинамики.
Из (31) => 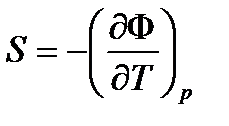 (34)
(34)
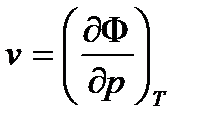 (35)
(35)
Свободная энтальпия – часть энтальпии (i), которая может быть использована в каких-либо технических целях. Энтальпию раньше называли теплосодержанием.
3) Смешанное сопряжение.
В этом случае в качестве независимых параметров выступают не все n потенциалов, а только r потенциалов от общего числа. Такие независимые потенциалы будем обозначать:
Pi, i=1,2,3,…,r., r <n
Независимые координаты обозначим как 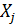
j=(r+1),(r+2),…,n
Опуская вывод (аналогичен случаю 1), сразу запишем окончательное выражение.
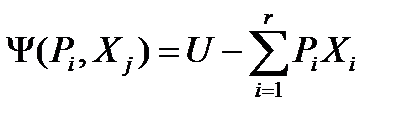 (36)
(36)
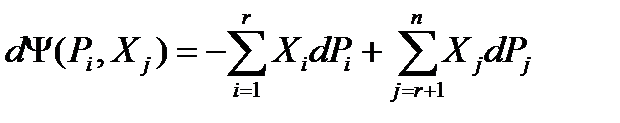 (37)
(37)
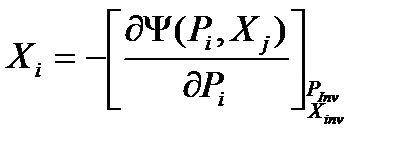 (38)
(38)
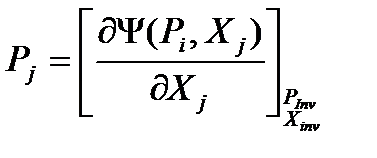 (39)
(39)
Рассмотрим термодеформационную систему
| X | S | V |
| P | T | -p |
1) Пусть независимым образом изменяется потенциал – Т и независимая координата – v:
Тогда из (36) =>Y(T,v) = U – TS
Эта характеристическая функция имеет свое обозначение и название.
F=U-TS (40)
Уравнение (40) это свободная энергия
В химической термодинамике F называется изохорно-изотермическим потенциалом.
В соответствие с формулой (37) дифференциал этой функции:
dF = – S dT – p dv (41)
По физической сути это одна из форм первого начала термодинамики.
Из формул (38), (39) следует:
 (42)
(42)
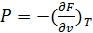 (43)
(43)
Если рассмотреть в формуле (41) изотермический процесс, где T=const, то dFT = – p dv (44)
так как dA = p dv, то в соответствии с формулой (44) в изотермических процессах абсолютная работа, совершаемая системой, производится за счёт убыли свободной энергии ∆FT=-AT или:
AT= -∆FT (45)
Ранее отмечалось, что в изотермических процессах вся подведённая к системе теплота идёт на совершение абсолютной работы.
2) Независимым потенциалом является абсолютной давление (P), а независимой координатой энтропия (S).
В соответствии с формулами (36-39) можно записать
Y(p,S) = U + pv, эта характеристическая функция называется энтальпией i.
i = U + pv [ 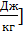 (46)
(46)
По физическому смыслу произведение p на v это потенциальная энергия одного килограмма газа при давлении p и удельного объема v.
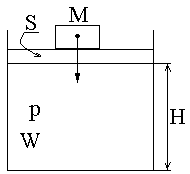
S- Площадь поршня
M- Масса груза
P- Давление в системе (газа под поршнем)
W-Объем системы (газа под поршнем)
H- Высота поднятия поршня
Из физики известно, что потенциальная энергия груза определяется как Eпот=MgH, так как система находится в равновесии то Mg=pS, тогда
Eпот = pSH = pW.
Если отнести Eпот к 1 кг системы, то 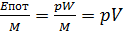
Так как внутренняя энергия идеального газа зависит только от температуры и не учитывает давление газа, то энтальпия полнее учитывает энергетические возможности системы с точки зрения совершения работы.
Di=VdP+TdS (47)
Как известно, TdS=dQ, тогда уравнение примет вид:di=VdP+dQ
Рассмотрим частный случай, где P=const (изобарный)
Dip=dQp (48)
После интегрирования получим
∆ip=i2-i1=Qp или Qp=i2-i1 (49)
Из формулы (49) следует, что в изобарных процессах теплота процесса определяется как разность энтальпии, конечного и начального состояния.
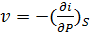 (50)
(50)
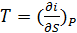 (51)
(51)
Рассмотрим формулу (47) di=VdP+TdS, тогда di=VdP+dQ или
dQ=di-VdP (52)
Уравнение (52) это первое начало термодинамики в энтальпийной форме.
Введем обозначение Aрасп. Располагаемая работа- это работа, которая может быть передана другой системе.
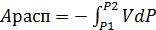 (53)
(53)
Рассмотрим произвольный процесс расширения системы 1-2
P
P1
P2
V1 V 2 V
С учетом (53) уравнение (52) запишется как
dQ=di+dAрасп (54)
Формулировка первого начала термодинамики в энтальпийной форме из (54):
Подведенная к системе теплота идее на изменение ее энтальпии и не совершает располагаемой работы.
Мнемонический приём для термодеформационной системы:
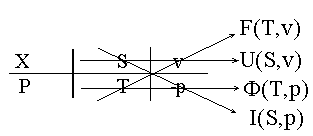
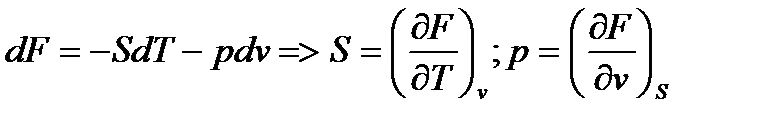
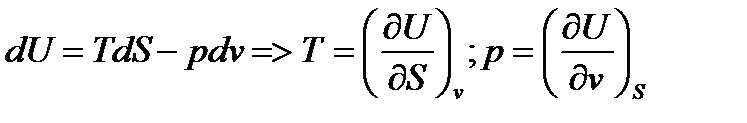
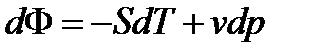
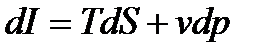 , и т.д.
, и т.д.
Дата добавления: 2022-05-27; просмотров: 103;










