Теория теплоёмкости разнородных систем.
2.1. Виды теплоемкостей.
Однородными называются системы, у которых свойства в различных её частях одинаковы.
Теплоёмкостью называется количество теплоты, необходимое для изменения температуры единицы количества вещества на 1градус.
₵ 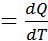
В зависимости от того, что является единицей измерения количества вещества. Различают:
1) массовую (удельную) теплоёмкость 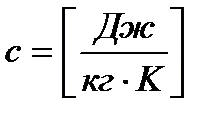 ;
;
2) мольную (молярную) теплоёмкость 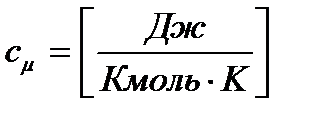
Примечание: 1 Кмоль – количество вещества в кг, численно равное его молекулярной массе;
3) объёмная теплоёмкость Cw, 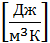 т.к. объём занимаемый газом зависит от его давления и температуры, то объёмные теплоёмкости в справочной литературе, как правило, даются для нормальных физических условий.
т.к. объём занимаемый газом зависит от его давления и температуры, то объёмные теплоёмкости в справочной литературе, как правило, даются для нормальных физических условий.
НФУ: Рн=101325 Па (760 мм.рт.ст.)
Тн=273,15 К
Объемная теплоемкость с массовой связаны следующим соотношением:
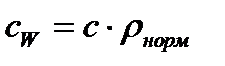 ,
,
Где rнорм = 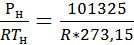 – плотность вещества при НФУ
– плотность вещества при НФУ
Из определения теплоёмкости имеем (59) 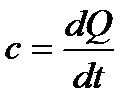 , отсюда следует, что у каждого процесса есть своя теплоёмкость, то есть для изменения температуры единицы количества вещества на один градус в разных процессах потребуется различное количество теплоты.
, отсюда следует, что у каждого процесса есть своя теплоёмкость, то есть для изменения температуры единицы количества вещества на один градус в разных процессах потребуется различное количество теплоты.
Таким образом по видам процессов различают: изохорную, изобарную, изотермическую, адиабатную теплоемкость, а также теплоемкости политропного процесса.
Тогда для изохорного процесса различают:
Сv - массовая изохорная теплоемкость
сmv –мольная (молярная) изохорная теплоёмкость;
cWv – объёмная изохорная теплоёмкость.
Для изобарного процесса (p=const) имеем:
cp – массовая изобарная теплоёмкость.
сmp – (молярная) мольная изобарная теплоёмкость;
cWp – объёмная изобарная теплоёмкость.
В справочной литературе содержится значение только изохорной и изобарной теплоемкостей. Изотермических и адиабатных теплоемкостей в справочниках нет, потому что заранее известно что:
cT = сmT = cWT = ¥
то есть все изотермические теплоемкости равны ¥, а адиабатные теплоемкости равны 0, этот результат следует из формулы (59).
Дата добавления: 2022-05-27; просмотров: 80;










