Уравнения состояния реальных газов.
При высоких давлениях и высоких температурах уравнения Менделеева-Клапейрона использовать нельзя, так как оно не качественное, не количественное не описывает реальные процессы. В этих случаях необходимо использовать уравнение состояния реального газа.
Известно много уравнений состояния реального газа. Наиболее теоретически обоснованными являются уравнения состояния реального газа в виде бесконечного ряда с вириальными коэффициентами:
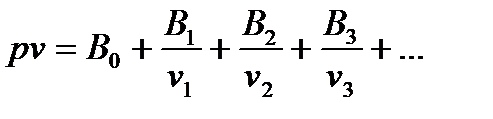 (12*)
(12*)
Здесь B0, B1, B2, B3, … , соответственно 0,1,2,3…- вириальные коэффициенты.
Они определяются по специальным методикам с использованием опытных данных.
Исторически первым из уравнений состояния реального газа было получено в 1887 году уравнение Ван-дер-Ваальса в виде:
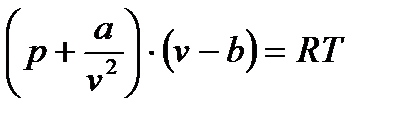 (13*)
(13*)
v- удельный объем
b – поправка на собственный объём молекул.
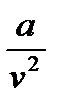 - поправка на межмолекулярное взаимодействие
- поправка на межмолекулярное взаимодействие
С помощью уравнения Ван-дер-Ваальса удалось впервые используя одно уравнение описать непрерывный процесс перехода вещества из одной фазы в другую, например сжижения газа при постоянной температуре.
Как показали многочисленные опыты, процесс описания реального газа имеет следующий характер
Рассмотрим изотермическое сжатие газа (t = const).
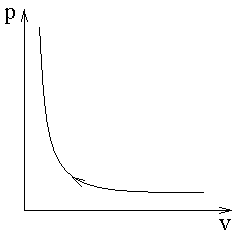
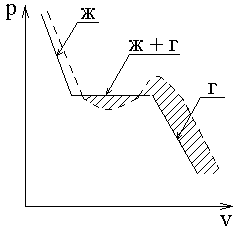
- - - - - уравнение Ван-дер-Ваальса.
Уравнения Менделеева-Клапейрона при постоянной температуре записывается как pv = const – это уравнение изображается в pv-координатах в виде гиперболы 1-го порядка.
 - область метастабильного состояния вещества.
- область метастабильного состояния вещества.
Ассоциация молекул – объединение двух и более молекул в группы.
В уравнении Ван-дер-Ваальса поправки на ассоциации молекул нет.
При высоких давлениях (более 50 МПа), при высоких температурах (1000-3000 К) поправка на межмолекулярное взаимодействие мала, и ею можно пренебречь.
В этом случае уравнение Ван-дер-Ваальса превращается в уравнение:
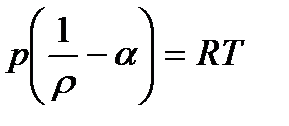 - уравнение Дюпре (14)
- уравнение Дюпре (14)
Уравнение (14) называется уравнением Дюпре, где r - плотность газа, a- коволюм (поправка на собственный объем молекул, a=b в уравнении Ван-дер-Ваальса)
Все известные уравнения состояния реального газа по своей сути являются частными случаями, в частности, для практических расчётов часто используют уравнение Майера-Боголюбова(1946 год):
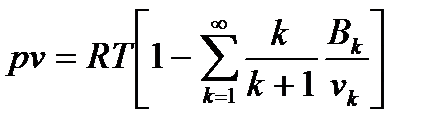
(15)
Где Bk – k-тый вириальный коэффициент.
Если система находится под разряжением (то есть в системе вакуум), то уравнение (15) достаточно взять k=1
k-это счетчик, который принимает значение от 1 до бесконечности.
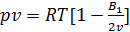 , здесь v-удельный объем.
, здесь v-удельный объем.
Для расчёта процессов с водяным паром широко используется уравнение Вукаловича-Новикова:
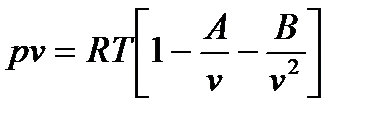 , где A, B – вириальные коэффициенты.
, где A, B – вириальные коэффициенты.
Дата добавления: 2022-05-27; просмотров: 192;










