Произведение растворимости и растворимость. Условие выпадения осадка.
Гетерогенными называются химические и физико-химические процессы, которые происходят в системах, состоящих из нескольких фаз. Фазы могут быть жидкими, твердыми и газообразными.
Отдельные части гетерогенной системы, разграниченные поверхностями раздела, называются фазами.
В лекции будет рассмотрено фазовое равновесие жидкость – твердое вещество, как имеющее наибольшее значение для разделения элементов, качественного и количественного определения.
Рассмотрим равновесие в системе малорастворимого сильного электролита АаВв, опустив для простоты заряды ионов:
АаВвтв ó aA + вВ
Это равновесие описывается термодинамической константой равновесия:
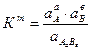
Активность твердой фазы есть величина практически постоянная, произведение двух констант даст новую константу, которую называют термодинамическим произведением растворимости (ПР):
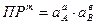
В растворе над осадком малорастворимого сильного электролита произведение активностей ионов в степенях соответствующих стехиометрических коэффициентов есть величина постоянная при данных условиях (температура, давление, растворитель).
В немецкой литературе ПР обозначается Lp (löslichkeitsprodukt), в английской – Sp (solubility product).
ПРт = f(T, P, природы растворителя)
Значения термодинамического произведения растворимости для Различных соединений приведены в справочниках (например, в справочнике Ю.Ю. Лурье. Справочник по аналитической химии).
В реальных условиях на равновесия влияют электростатические силы (ионная сила растворов) и химические взаимодействия (побочные реакции с ионами осадка), вследствие чего растворимость осадка меняется.
Дата добавления: 2017-03-12; просмотров: 1216;










