Теплота процесса не зависит от пути процесса, а определяется только начальным и конечным состояниями системы.

Q1+Q2+Q3+Q4+Q5+Q6 = Q7+Q8
Он является следствием I закона термодинамики.
Закон Гесса позволяет обращаться с термохимическими уравнениями, как с алгебраическими. Термохимические уравнения можно складывать друг с другом или вычитать, а также умножать на одно и тоже число.
Закон Гесса позволяет вычислить тепловой эффект любой реакции, если знать теплоты образования веществ или теплоты их сгорания.
Теплотой образования называется тепловой эффект при образовании из простых веществ одного моль соединения. При этом теплота образования простых веществ принимается равной нулю.
Теплотой сгорания называется тепловой эффект (при постоянном давлении) реакции окисления кислородом одного моль химического соединения с образованием следующих продуктов реакции: CO2, SO2, H2O, N2.
Теплоты образования и теплоты сгорания большинства веществ известны из экспериментальных измерений в стандартных условиях. Их значения приводятся в справочниках.
Из закона Гесса вытекают два важных следствия.
1. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ с учётом их стехиометрических коэффициентов
∆H = 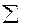 υпрод ∆Hобрпрод -
υпрод ∆Hобрпрод - 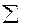 υисх ∆Hобрисх (17).
υисх ∆Hобрисх (17).
2. Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и теплот сгорания продуктов реакции с учетом их стехиометрических коэффициентов:
∆H = 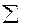 υисх ∆H сг исх -
υисх ∆H сг исх - 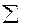 υпрод ∆Hсг прод (18).
υпрод ∆Hсг прод (18).
Поскольку тепловой эффект и энтальпия зависят от давления и температуры, то их относят к стандартному состоянию, которое определяется следующими параметрами:
Р = 101325 Па Т = 298 К при этом тепловой эффект может обозначаться следующими символами ∆H0298 или ∆H0.
Дата добавления: 2017-02-13; просмотров: 1690;











