Основные положения молекулярно-кинетической теории строения вещества. Количество вещества. Молярная масса. Силы молекулярного взаимодействия.
Молекулярно-кинетической теорией называется учение, которое объясняет свойства материи с точки зрения движения и взаимодействия составляющих её молекул.
Молекулой называется наименьшая устойчивая частица вещества, обладающая его основными химическими свойствами.
Молекулы, как известно, могут состоять как из одного (инертные газы), так и из огромного количества атомов (биологические молекулы).
Атом – это наименьшая частица химического элемента.
В основе молекулярно-кинетической теории лежат три аксиомы, называемые положениями:
1) все вещества состоят из мельчайших частиц - молекул, которые в свою очередь, состоят из атомов;
2) молекулы находятся в непрерывном хаотическом движении, называемом тепловым;
3) молекулы взаимодействуют с силами одновременного притяжения и отталкивания, имеющими электрическую природу.
Реальные размеры атомов очень малы и составляют в диаметре не более нескольких ангстрем (1А=10-10м), например, d(H2O)=3 10-10м.
Массу атомов и молекул в силу их малости принято измерять не в привычных нам граммах, или килограммах, а с помощью атомных единиц массы.
Атомная единица массы составляет 1/12 часть атома углерода 12С и равна:
1 а.е.м. =1/12 mc =1,66 10-27кг.
Относительная атомная (молекулярная) масса – это отношение массы атома (молекулы) данного вещества к одной атомной единице массы:
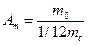 . (1)
. (1)
Спектр, рассматриваемых молекулярной физикой веществ, очень разнообразен, однако во многих задачах особенности строения молекул данного конкретного соединения не имеют значения. В этих случаях удобнее пользоваться не массой, а количеством вещества.
Единицей количества вещества является моль.
Один моль – количество вещества, содержащего столько же молекул, сколько их содержится в 0,012кг углерода.
Величина, численно равная, количеству атомов в 12 г углерода называется числом Авогадро,
Na=6,023 1023 1/моль.
Таким образом, количество вещества – это отношение числа молекул в данном веществе к числу Авогадро: 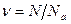 .
.
Хотя, моль любого вещества (по определению) содержит одинаковое количество молекул, масса молей разных веществ – различна.
Масса одного моля вещества называется молярной 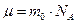 , где m0 – масса молекулы.
, где m0 – масса молекулы.
С учётом молярной массы количество вещества равно:
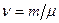 .
.
Силы, с которыми взаимодействуют молекулы (молекулярные) имеют электрическую природу. Эти силы действуют на расстояниях, соизмеримых с размерами самих молекул.
Силы взаимодействия зависят от расстояния между молекулами (рис.1а).
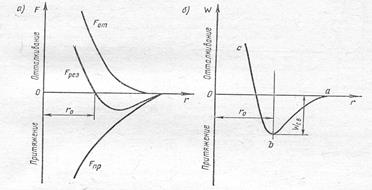 Силы отталкивания преобладают при сближении молекул (r<r0). Они обусловлены перекрыванием электронных оболочек атомов.
Силы отталкивания преобладают при сближении молекул (r<r0). Они обусловлены перекрыванием электронных оболочек атомов.
На некотором расстоянии r = r0 силы притяжения Fпр. и силы отталкивания Fотт. уравновешивают друг друга.
Дальнейшее увеличение расстояния приводит в начале к притяжению, а затем к исчезновению всякого взаимодействия.
При этом силы притяжения убывает с расстоянием по закону Fпр.= - а/r7, а силы отталкивания по закону Fотт= b/r12.
Коэффициенты а и в зависят от рода
Рис.1а Рис.1б взаимодействующих молекул.
Результирующая сил молекулярного взаимодействия будет равна:
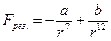 . (2)
. (2)
На рис.1б представлен график потенциальной энергии двух молекул на расстоянии r друг от друга. Из графика можно сделать вывод о том, что наименьшей потенциальной энергией система из двух молекул обладает в точке, в которой силы притяжения и отталкивания равны.
Дата добавления: 2017-01-16; просмотров: 1539;











