Диаграмма состояния системы «железо – углерод»
Диаграмма состояния железо – углерод (Рис.37.) дает представление о строении железоуглеродистых сплавов – сталей и чугунов. Первое представление о диаграмме железо – углерод дал Д.К.Чернов, который в1868 году отметил существование в стали критических точек, и их зависимость от содержания в стали углерода, т.е. по сути, впервые указал на полиморфизм железа. Содержание углерода в диаграмме Fe – C (цементит) ограничивается 6,67%, так как при этой концентрации образуется химическое соединение – карбид железа (Fe3C) или цементит, который и является вторым компонентом данной диаграммы.
Железо – металл серебристо - белого цвета, мягкий. Чистое железо содержит 99,91% Fe. Температура плавления железа 1539ºС. До температуры 768ºС железо магнитное. Температура, при которой железо теряет свои магнитные свойства, называется точкой Кюри. Железо имеет две аллотропические модификации: Fe 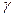 и Fe
и Fe 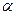 . Железо
. Железо 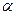 существует при температурах ниже 911ºС и выше 1401ºС. В интервале температур 911-1401ºС существует железо
существует при температурах ниже 911ºС и выше 1401ºС. В интервале температур 911-1401ºС существует железо 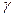 .
.
Второй компонент сплава – углерод– также имеет несколько аллотропических разновидностей, отличающихся между собой по внешнему виду, а также по физико-химическим свойствам: графит, алмаз и уголь. Графит – мягкое вещество, пластичен. Алмаз – самое твердое в природе вещество, хрупок, обладает высокой износостойкостью.
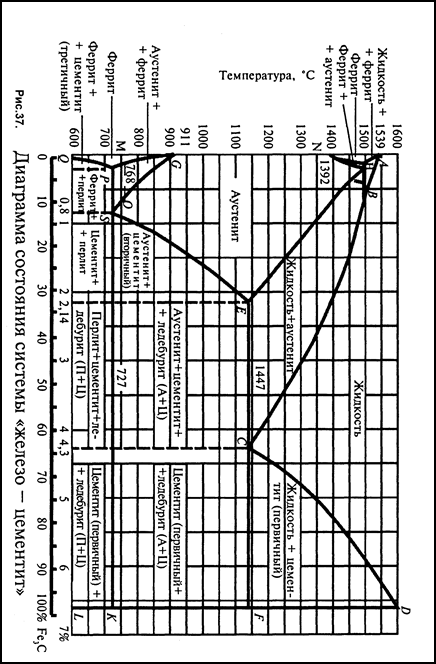
По диаграмме можно определить структуру сплавов как после медленного охлаждения, так и после нагрева. Согласно диаграмме состояния для железоуглеродистых сплавов характерны следующие фазовые и структурные составляющие.
Однофазные составляющие.
Феррит – твердый раствор углерода в железе 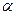 . При комнатной температуре в феррите может раствориться не более 0,006 % углерода. Феррит (почти чистое железо) обладает небольшой прочностью и твердостью (НВ 80-100).
. При комнатной температуре в феррите может раствориться не более 0,006 % углерода. Феррит (почти чистое железо) обладает небольшой прочностью и твердостью (НВ 80-100).
Цементит – химическое соединение железа с углеродом (карбид железа), отвечающее формуле Fe3C. Содержание углерода в цементите составляет 6,67% и не изменяется вплоть до температуры плавления. это самая твердая структурная составляющая стали (НВ 750-800); цементит имеет высокую прочность но чрезвычайно хрупок ( 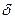 = 0%); магнитен.
= 0%); магнитен.
Аустенит – твердый раствор углерода в железе 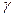 . Максимальная растворимость углерода в аустените 2,14% при 1147º. Аустенит имеет невысокую твердость (НВ 170-200), достаточно высокую прочность наряду с хорошей пластичностью (
. Максимальная растворимость углерода в аустените 2,14% при 1147º. Аустенит имеет невысокую твердость (НВ 170-200), достаточно высокую прочность наряду с хорошей пластичностью ( 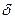 = 40-50%), большую стойкость против коррозии, высокое электросопротивление, немагнитен. Микроструктура аустенита представляет зерна в виде многогранников.
= 40-50%), большую стойкость против коррозии, высокое электросопротивление, немагнитен. Микроструктура аустенита представляет зерна в виде многогранников.
Двухфазные структуры.
Перлит – механическая смесь феррита и цементита (после травления эта структура имеет перламутровый отлив, отсюда и название перлит). Различают два вида перлита – пластинчатый (цементит в виде пластинок) и зернистый (цементит в виде зернышек). Зернистый перлит имеет более высокие механические свойства, чем пластинчатый, занимая промежуточное место между ферритом и цементитом ( НВ 200-250). Перлит содержит 0,83% углерода, обладает высокой прочностью и упругостью, но незначительной вязкостью.
Ледебурит (эвтектика) – смесь аустенита и цементита. Ледебурит (по имени немецкого ученого А.Ледебура) образуется при кристаллизации жидкого раствора постоянного состава (4,3%С) при температуре 1147ºС. Ледебурит имеет очень высокую твердость (800HV), очень хрупок.
В зависимости от содержания углерода железоуглеродистые сплавы подразделяются на стали и чугуны.
Сталями называются железоуглеродистые сплавы, содержание углерода в которых не превышает 2,14%. Стали с содержанием углерода до 0,8% называются доэвтектоидными, 0,8% - эвтектоидными и более 0,8% - заэвтектоидными.
Чугунами называются сплавы железа с углеродом, содержащие углерода более 2,14%. Чугуны, содержащие менее 4,3% углерода, называются доэвтектическими, содержащие 4,3% - эвтектическими и более 4,3% - заэвтектическими.
Диаграмма состояния железо – углерод построена на координатных осях. По горизонтальной оси отложено процентное содержание углерода, по вертикальной – температура сплава.
Превращение из жидкого состояния в твердое (первичная кристаллизация) для всех сплавов начинается по линии АСD, т.е. по линии ликвидуса. При этом сплавы, содержащие 0 – 4,3% С, начинают затвердевать по линии АС, выделяя зерна аустенита, а сплавы, содержащие более 4,3% С, начинают затвердевать по линии СD, выделяя из жидкого сплава зерна цементита. Точка С соответствует эвтектической точке. Сплав, содержащий 4,3% углерода, - эвтектический сплав – затвердевает при постоянной температуре 1147ºС (ледебурит).
Кривая AECF (линия солидуса) соответствует концу кристаллизации сплавов. Одной из наиболее важных точек диаграммы состояния Fe –Fe3C является точка Е, лежащая при температуре 1147º и соответствующая содержанию углерода 2,14%. Точка Е характеризует наибольшее количество углерода, которое может растворить в себе 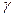 -железо при 1147ºС. С понижением температуры растворимость углерода в
-железо при 1147ºС. С понижением температуры растворимость углерода в 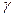 - железе уменьшается по линии ES и при температуре 727º (точка S) становится равной 0,83%.все сплавы содержащие более 2,14% С, имеют постоянную температуру конца затвердевания 1147º.
- железе уменьшается по линии ES и при температуре 727º (точка S) становится равной 0,83%.все сплавы содержащие более 2,14% С, имеют постоянную температуру конца затвердевания 1147º.
Превращения в твердом состоянии.
Чтобы лучше понять условия образования структур железоуглеродистых сплавов, которые происходят в твердом состоянии, рассмотрим процессы вторичной кристаллизации, пользуясь левой нижней частью диаграммы (Рис.38.).
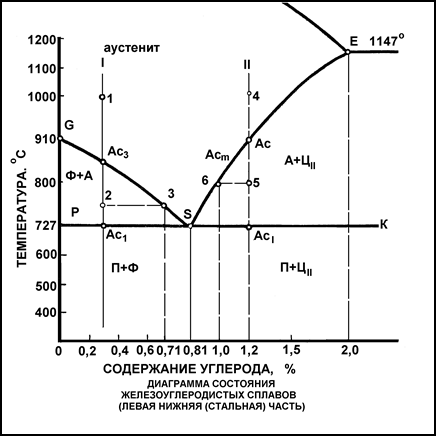
Рис.38. Диаграмма состояния железоуглеродистых сплавов (левая нижняя (стальная) часть)
Вторичная кристаллизация в сплавах железо – углерод связана с переходом при охлаждении 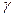 - железа в
- железа в 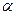 - железо и соответствующим распадом аустенита. Линия GS на диаграмме состояния соответствует началу распада аустенита с выделением из него феррита. Принято критические точки, образующие линию GS, обозначать при нагреве Аc3 , а при охлаждении Аr3. линия ES указывает на уменьшение предела растворимости углерода в
- железо и соответствующим распадом аустенита. Линия GS на диаграмме состояния соответствует началу распада аустенита с выделением из него феррита. Принято критические точки, образующие линию GS, обозначать при нагреве Аc3 , а при охлаждении Аr3. линия ES указывает на уменьшение предела растворимости углерода в 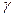 - железе с понижением температуры – следовательно, она соответствует началу распада аустенита с выделением из него избыточного углерода в виде цементита. Температурные точки образующие линию ES, принято обозначать Acm. Точка S, соответствующая 0,83%С, показывает минимальную температуру равновесного существования аустенита. После понижения температуры до точки S происходит окончательный распад аустенита с одновременным выделением из него феррита и цементита, образующих эвтектоидную смесь перлит. Для всех сплавов железо – углерод распад аустенита с образованием перлита соответствует точкам линии PSK точки, соответствующие этой температуре, при охлаждении обозначают Ar1 , а при нагреве Ac1.
- железе с понижением температуры – следовательно, она соответствует началу распада аустенита с выделением из него избыточного углерода в виде цементита. Температурные точки образующие линию ES, принято обозначать Acm. Точка S, соответствующая 0,83%С, показывает минимальную температуру равновесного существования аустенита. После понижения температуры до точки S происходит окончательный распад аустенита с одновременным выделением из него феррита и цементита, образующих эвтектоидную смесь перлит. Для всех сплавов железо – углерод распад аустенита с образованием перлита соответствует точкам линии PSK точки, соответствующие этой температуре, при охлаждении обозначают Ar1 , а при нагреве Ac1.
Проследим за процессом вторичной кристаллизации доэвтектоидной стали марки Ст.3 содержащей около 0,3% С. Допустим сталь нагрета до 1000º (точка 1 на диаграмме). При этой температуре структура стали состоит из твердого раствора – аустенита. Когда температура понизится до 830º (точка Ас3 на диаграмме), начинается процесс превращения 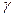 - железа в
- железа в  - железо и образование феррита. Таким образом, сталь при температуре ниже линии GS будет иметь двухфазную структуру – аустенит и феррит. При дальнейшем понижении температуры концентрация углерода в аустените будет возрастать и после температуры линии PSK составит 0,83% (точка S). Аустенит, получив эвтектоидную концентрацию, распадается при постоянной температуре с образованием перлита. Таким образом, доэвтектоидные стали после окончательного охлаждения будут состоять из перлита и феррита.
- железо и образование феррита. Таким образом, сталь при температуре ниже линии GS будет иметь двухфазную структуру – аустенит и феррит. При дальнейшем понижении температуры концентрация углерода в аустените будет возрастать и после температуры линии PSK составит 0,83% (точка S). Аустенит, получив эвтектоидную концентрацию, распадается при постоянной температуре с образованием перлита. Таким образом, доэвтектоидные стали после окончательного охлаждения будут состоять из перлита и феррита.
По диаграмме легко определить процентное содержание углерода в зернах аустенита при любой температуре между точками Ас3 и Ас1. Допустим, что необходимо узнать, каково содержание углерода в зернах аустенита при температуре 750º (точка 2 на диаграмме). Для этого проводим линию 2-3 до пересечения с линией GS в точке 3. Спроектировав точку 3 на горизонтальную ось диаграммы, определим, что в зернах аустенита при 750º содержится 0,71% углерода.
При охлаждении заэвтектоидных сталей происходят другие процессы. Линия ES характеризует изменение растворимости углерода в аустените с понижением температуры. Выше линии ES существует только аустенит. При понижении температуры до линии ES аустенит оказывается насыщенным углеродом, который при дальнейшем охлаждении выделяется в виде цементита. Образующийся в данном случае цементит в отличие от цементита, который выделяется из жидкого сплава, называется цементитом вторичным. Следовательно, при температурах ниже линии ES будем иметь структуру: аустенит и вторичный цементит. При выделении цементита аустенит обедняется углеродом. При 727º концентрация углерода в аустените составляет 0,83% и при этой постоянной температуре он распадается на феррито-цементитную смесь - перлит. Таким образом, заэвтектоидные стали после окончательного охлаждения будут иметь структуру, состоящую из перлита и избыточного (вторичного) цементита.
Чугуны.
Чугун –самый распространенный железоуглеродистый нековкий литейный материал, содержащий свыше 2,14 % углерода, до 4,5% кремния, до 1,5% марганца, до 1,8% фосфора и до 0,08% серы.
Производство чугуна.
Основным способом получения чугуна является доменный процесс. Наибольшее количество чугуна идет на производство стали, некоторая часть доменного чугуна поступает на производство чугунных отливок.
Производство черных металлов включает в себя пять последовательно взаимосвязанных стадий: добычу сырья, подготовку его к плавке, выплавку в доменных печах чугуна, переплавку чугуна в сталь, прокат стальных слитков.
Исходные материалы для доменного процесса.
Для выплавки чугуна нужны железная руда, флюсы и топливо.
Железные руды. Руда (природное минеральное сырье) содержит металлы или их соединения в концентрациях и формах, приемлемых для промышленной переработки.
Виды железных руд.
1. Магнитный железняк содержит железо в виде окисла Fe3O4. Руда черного цвета, содержание Fe в среднем 60 – 70%.
2. Красный железняк содержит железо в виде окисла Fe2О3. руда красного цвета содержит Fe 50 – 60%. Это одна из лучших железных руд: легко восстанавливается, содержит малый процент серы и фосфора.
3. Бурый железняк содержит железо в виде водного окисла. Наиболее распространенными являются лимонит (2Fe2O3 * 3H2O) и гетит (Fe2O3 * H2O). Содержание железа 40 - 50%.
4. Сидериты (FeCO3) – это наиболее бедные руды. Содержание железа в них 35 – 40%. Разновидности этих руд: шпатовый железняк, глинистый железняк и углистый железняк.
В процессе доменной плавки кроме руд используются и различные отходы: чугунный лом, чугунная стружка, загрязненный стальной лом и марганцевые руды.
Флюсы обеспечивают сплавление пустой породы руды, вредных примесей и золы топлива в относительно легкоплавкие шлаки. При выплавке чугуна в качестве флюса используют известняк (CaCO3, иногда совместно с MgCO3).
Топливо является не только источником теплоты, но и реагентом, восстанавливающим металл из его оксидов и других соединений. В качестве металлургического топлива применяют кокс, в настоящее время широко применяется высококалорийный природный газ – метан СН4. Перспективным видом топлива является водород; его можно использовать для прямого восстановления железа.
Подготовка руд к плавке. Подготовка руд начинается с усреднения их химического состава. Затем руду сортируют по размерам: куски руды должны быть 15 – 35 и 35 – 50 мм. Обогащение руд ставит целью увеличение процентного содержания железа в руде за счет удаления пустой породы. Обогащение руд производиться различными способами, к ним относятся: промывка, магнитное обогащение. Так же производится обжиг руд благодаря которому железо, содержащиеся в руде в виде химического соединения Fe2O3, удается перевести в магнитный окисел Fe3O4, и после этого производят магнитное обогащение.
Промывают руду водой, которая подается во вращающиеся барабаны под давлением, при этом происходит механическое отделение пустой породы, которая уносится водой.
Магнитное обогащение применяется для руд, обладающих магнитными свойствами. Мелкоизмельченная руда подается на вращающиеся барабаны, внутри которых закреплены неподвижные мощные электромагниты. Железные окислы содержащие Fe в виде Fe3O4, магнитны; притягиваясь к барабану они удерживаются на нем, а пройдя магнитное поле попадают в специальное отделение. Пустая порода центробежной силой отбрасывается в сторону.
Агломерациейназывается процесс спекания мелких и порошкообразных руд, рудной пыли и окалины с коксовой мелочью. Агломерат является ценнейшим материалом для плавки чугуна, он очень легко восстанавливается, богат железом.
Огнеупорные материалы применяют для создания защитной внутренней облицовки (футеровки) металлургических печей, разливочных ковшей, химических аппаратов и т.д. Они должны обладать следующими свойствами: высокой температурой размягчения, хорошей химической стойкостью и постоянством объема при резких падениях температур. Огнеупоры подразделяются на:
- кислые – динас: 93 – 96 % SiO2, связка 2 – 3 % СаО; tраб до 1730º С;
- основные – магнезит: 91 – 94% MgO, связка 1 - 2 % СаО (остальное – Fe2O3, SiO2, Al2O3); tраб до 2000º С и выше (под нагрузкой размягчается при 1500º С);
- нейтральные: шамотные, высокоглиноземные и хромитовые. Шамотные огнеупоры состоят из 28 -45 % Al2O3 и 50 -60 % SiO2; tраб до 1200º С (под нагрузкой) и до 1730º С без нее. Высокоглиноземные (72 – 95 % Al2O3) изделия сохраняют огнеупорность до 1920º С. Хромитовые содержат более 30 % Cr2O3 и до 40 % MgO, tраб до 1800º С.
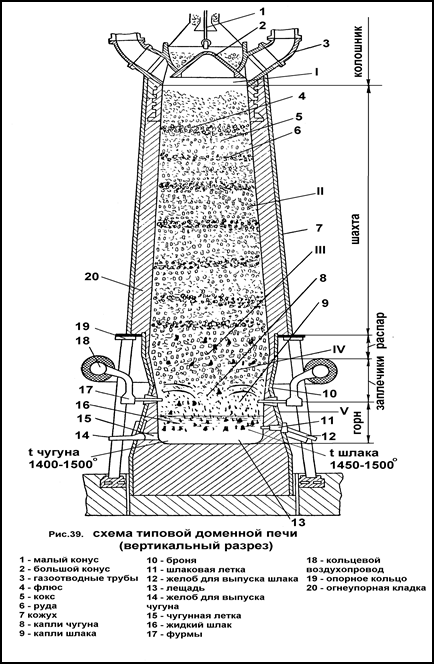
Доменная печь
Современная доменная печь принадлежит к числу самых высокопроизводительных агрегатов для переработки веществ. Помимо чугуна она дает колошниковый газ и доменный шлак, которые также используются в промышленности. Суточная производительность крупнейших домен сейчас достигает 10000 т чугуна.
Доменная печь (Рис.39) представляет собой печь шахтного типа, состоящую из колошника I, шахты II, распара III, заплечиков IV и горна V.
В колошник – верхнюю цилиндрическую часть печи – при помощи засыпного аппарата загружают шихтовые материалы, называемые шихтой; там же находится загрузочно-распределительное устройство, обеспечивающее правильное распределение материалов шихты в печи и предотвращающее утечку газов. Наиболее распространенная конструкция засыпного аппарата состоит из малого конуса 1 и большого конуса 2. К колошнику прикреплены газоотводные трубы, через которые отводят колошниковый газ. Температура в колошнике от 150 до 300º С.
Шахта II имеет форму усеченного конуса, расширяющегося к низу. Это самая большая часть печи. В шахте происходят высушивание руды, выделение химически связанной воды, растрескивание руды и начинается восстановление ее окислов. Температура в шахте на разной высоте от 350 до 1200º С.
Распар III имеет цилиндрическую форму и является самой широкой частью доменной печи. В распаре начинаются шлакообразование и плавление металла. Температура в этой зоне около 1400º С и выше.
Заплечики IV имеют форму усеченного конуса, сужающего к низу. В них происходит дальнейшее расплавление металла и шлака. Температура достигает 1600-1900º С.
В верхней части горна V расположены фурмы 17 - устройство для вдувания в печь горячего воздуха, обеспечивающего горение топлива. Фурмы расположены по окружности горна. Их бывает шестнадцать и больше. Воздух в фурмы подают из кольцевого воздухопровода 18. В верхней части горна расположено отверстие для выпуска чугуна – чугунная летка 15. Выше чугунной летки устроена шлаковая летка 12 для выпуска шлака. Температура в горне достигает 1800º С. На дне горна, называемом лещадью (13), скапливаются жидкий чугун и шлак. Чугун выпускают из печи периодически (6-8 раз в сутки). Вместе с чугуном из печи вытекает шлак, который называют нижним. Верхним называют шлак, который выпускают через шлаковые летки. Основанием печи является тяжелый железобетонный фундамент. Шахта укреплена на колоннах связанных с фундаментом.
Доменный процесс.
Процесс получения чугуна состоит из трех стадий: восстановления железа из его окислов; науглероживание железа и шлакообразования.
В доменной печи непрерывно взаимодействуют шихтовые материалы, движущиеся сверху вниз, и продукты горения, движущиеся снизу вверх. Загрузка шихтовых материалов состоит в правильном чередовании поступления в печь руды, топлива и флюсов. Руда восстанавливается благодаря горению топлива (кокса или метана). Горение начинается в области горна. Через фурменные отверстия раскаленный воздух поступает в печь и на уровне фурм кислород воздуха вступает в реакцию с углеродом топлива:
С + О = СО2
Полученный углекислый газ поднимается к верху и вступает в соприкосновение с раскаленным коксом, при этом образуется окись углерода:
СО2 + С = 2СО
Окись углерода поднимается к верху; являясь сильным восстановителем, она вступает во взаимодействие с окислами железа и восстанавливает их. Восстановление идет в строгой последовательности от высших к низшим окислам, т.е. от менее прочных к более прочным:


 Fe2O3 Fe3O4 FeO Fe
Fe2O3 Fe3O4 FeO Fe
При температуре 900 - 1000º С окись углерода вступает в реакцию с чистым железом:
3Fe + 2CO = Fe3C + CO2
образуется карбид железа Fe3С, который способствует науглероживанию железа, растворяясь в нем. Науглероженное железо (1,8 – 2%) переходит в жидкое состояние, стекает каплями между кусками раскаленного кокса, дополнительно насыщается углеродом идо 3,5 -4 % и скапливается на лещади горна печи. Одновременно с восстановлением и науглероживанием железа происходит восстановление из шихты кремния, марганца, серы, фосфора. Эти элементы восстанавливаются главным образом твердым углеродом. Реакции идут с поглощением тепла при высоких температурах 1200 - 1300º С.
Марганец восстанавливается твердым углеродом по реакции
MnO + C = Mn +CO + Q
Восстановление кремния идет по реакции
SiO2 + 2C = Si + 2СO – Q
протекающей при более высоких температурах (1450º С).
Фосфор, находящийся в рудах в виде фосфорнокислого кальция Ca3P2O8 , восстанавливается также раскаленным углеродом топлива в присутствии SiO2.
Сера, частично образуя с железом соединение FeS, растворяется в остальном железе.
В результате восстановления всех указанных элементов в доменной печи получается чугун - сплав железа с углеродом, марганцем, кремнием, серой и фосфором.
Для выплавки одной тонны чугуна расходуют около 1,8 т руды, 0,7-0,8 т кокса, 0,25-0,40 т флюса и 3,5 т воздуха.
Продукты доменного производства.
Чугун по назначению делиться на три группы: передельный, литейный и ферросплавы. Из всей выплавки более 80% составляет передельный чугуны, которые переплавляются в сталь, и около 20% приходиться на долю литейных чугунов и ферросплавов.
Шлаки являются продуктом взаимодействия флюсов с пустой породой, золой топлива, огнеупорной футеровкой печи и вредными примесями при выплавке металла. Шлаки подразделяются на кислые (кварциты Si2O), основные (CaO, MgO, MnO, FeO) и нейтральные(Al2O3, щелочные и щелочноземельные хлориды и фториды).
Колошниковый газ – также важный побочный продукт. Это высококалорийное топливо, в состав которого входит около 35 % окиси углерода СО, 2 – 3 % водорода Н2, 0,5 % метана, остальное – азот.
Колошниковую пыль используют как сырье для агломерации.
Дата добавления: 2016-12-27; просмотров: 5156;











