Типы связей в металлах и неметаллах.
Строение и свойства металлов.
Металлы – это твердые при комнатной температуре вещества (за исключением ртути), с металлическим блеском, высокой тепло- и электропроводностью.
Твердые вещества по взаимному расположению атомов делятся на аморфные и кристаллические (Рис.1.).
Аморфныминазывают твердые вещества, атомы которых располагаются в пространстве хаотично. К таким веществам относят стекло, смолу, канифоль и др.
Кристаллическими называют твердые вещества, в которых атомы расположены в пространстве в строго определенном порядке.
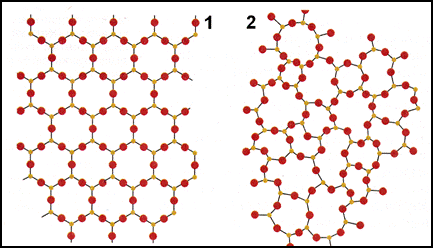
Рис. 1. Строение кристаллического (1) и аморфного (2) вещества.
Типы связей в металлах и неметаллах.
Внутренняя связность вещества – это результат сил взаимодействия между составляющими его частицами, которые могут взаимно притягиваться или отталкиваться.
Возникновение и величина сил взаимодействия между частицами, образующими вещество, зависят от типа их связей.
Различают четыре основных типа связи: 1) ионная, 2) ковалентная, 3) металлическая, 4) межмолекулярная.
Ионная связь возникает между такими атомами, у одного из которых на внешней оболочке содержится мало электронов, а у другого она почти заполнена.
Ковалентная связьвозникает, когда соседние атомы, стремясь заполнить свои внешние оболочки, объединяют требуемые для этого электроны.
Если на внешней оболочке меньше четырех электронов – что типично для металлов,- то все внешние электроны атомов внутри структурной единицы вещества образуют так называемый электронный газ, при этом каждый электрон свободно движется между атомными остовами и не принадлежит ни отдельному атому, ни какой либо малой группе их. Такая связь, называемая металлической, обусловлена взаимодействием между отрицательно заряженным электронным газом и положительно заряженными ионами – остовами атомов. Наличие металлической связи объясняет характерные свойства металлов. Благодаря свободным электронам при пластической деформации связь между ионами не нарушается и разрушения не происходит, что объясняет высокую пластичность металлов. Наличие свободных электронов обуславливает высокую электро- и теплопроводность металлов. С понижением температуры ослабляются тепловые колебания ионов, что повышает электропроводность и в ряде случаев приводит к явлению сверхпроводимости при температурах, близких к абсолютному нулю. Характерный металлический блеск объясняется взаимодействием световых волн со свободными электронами.
Межмолекулярная связьобусловлена силами, которые называют силами Ван-дер-Ваальса. Их природа пока недостаточно ясна.
Дата добавления: 2016-12-27; просмотров: 4846;











