Окислы (гидроокислы)
Окислы – соединения катионов с кислородом, в гидроокислах присутствует группа (ОН) - и Н2О.
Наиболее распространенными минералами этой группы являются окислы кремния, алюминия, железа, марганца и титана.
С химической точки зрения окислы делят на три класса:
- простые окислы – соединения одного катиона с кислородом (кварц, халцедон, корунд, рутил, гематит, касситерит);
- сложные окислы – соединение нескольких катионов с кислородом (магнетит, ильменит, хризоберилл, хромит);
- гидроокислы – соединения элементов с группой (ОН)- или Н2О (лимонит, гётит, диаспор, опал).
К простым окислам также относится лед, твердая кристаллическая разновидность Н2О.
Общая характеристика. В большинстве своем окислы обладают относительно простыми кристаллическими решетками с ионными типами связи. Разнообразие структур кристаллов обусловлено размерами катионов, их зарядом и поляризационными свойствами.
Часто окислы и гидроокислы встречаются в виде отдельных кристалл-лов, форма которых является их диагностическим признаком. Одни и те же окислы, образуясь в разных геологических условиях, могут образовывать разные по форме минеральные индивиды, т.е обладают типоморфными признаками.
Прочность кристаллических построек оксидов обуславливает ряд их физических свойств – высокую твердость (6,0 – 9,0), химическую устойчи-вость, тугоплавкость и труднорастворимость.
Структуры гидроокислов намного сложнее, что обусловлено слоистым строением их кристаллических решеток, вызванным заменой ионов О2- на анионные группы (ОН) -. Сложность структур гидроксилов заключается еще в смешанном типе химических связей (внутри слойков действует ионный тип связи, между слойками – вандерваальсовый). При замене ионов О2- на анионные группы (ОН) – происходит снижение симметрии кристалла за счет изменения его структурных особенностей. Например, Аl2О3 (корунд) кристаллизуется в тригональной сингонии, а AlО(ОН) (диаспор) в ромбической.
Гидроокислы за счет менее прочных кристаллических решеток характеризуются низкими значениями твердости от 1,0 до 5,0 и совершенной спайностью, проходящей параллельно слойкам.
В подавляющем большинстве окислы и гидроокислы непрозрачны и имеют темную бурую или алую окраску за счет катионов железа, марганца, хрома и т.д. Окислы в составе которых присутствуют ионы типа благородных газов и другие (Аl 3+, Mg 3+ и т.д.) бесцветны или имеют окраску, обусловленную различного рода включениями.
Некоторые окислы имеют несколько полиморфных модификаций и ряд минеральных разновидностей. Такими окислами являются кварц (около 12 полиморфных модификации и множество минеральных разновидностей), рутил (две полиморфные модификации), корунд (четыре минеральные разновидности).
Краткая характеристика минеральных видов и их разновидностей приведена в таблицах №№ 5 – 8.
Минеральные разновидности корунда. Появление минеральных разно-видностей корунда обусловлено изоморфными примесями, замещающими в кристаллической решетке ионы алюминия. Прозрачными драгоценными разновидностями корунда являются:
- лейкосапфир – бесцветный корунд;
- сапфир – синий корунд (за счет примеси ионов титана);
- рубин – красный, фиолетово-красный корунд (за счет примеси хрома);
Непрозрачная разновидность корунда называется наждаком.
Полиморфные модификации рутила. Полиморфными разновидностями рутила TiO2 являются брукит и анатаз.
В основу кристаллической структуры рутила положена плотнейшая гексагональная упаковка ионов кислорода, в основу анатаза – плотнейшая кубическая упаковка, а брукит состоит из «листов» гексагональной и кубической упаковок ионов кислорода. Таким образом, кристаллы рутила имеют призматический и удлиненно призматический габитус, кристаллы анатаза – дипирамидальный, а для брукита характерен уплощенный облик с вертикальной штриховкой на гранях.
Полиморфные модификации и минеральные разновидности минералов группы кварца (кварц, халцедон). Минералы группы кварца по своему кристаллическому строению занимают особое положение среди окислов. В химическом отношении являясь окислами, они имеют каркасную структуру, близкую к силикатам.
На сегодняшний день известно около 12 полиморфных модификаций кремнезема SiO2, но при атмосферном давлении устойчивыми являются только α-кварц (низкотемпературный – 0 – 5730 С), β-кварц (высокотемпера-турный – 573 – 8700 С), тридимит (870 – 14700 С) и кристобалит (1470 – 17100С) (рис. 31). Полиморфные модификации коэсит и стишовит были получены экспериментальным путем при высоких давлениях.
Наиболее распространенной является низкотемпературная поли-морфная модификация кремнезема – α-кварц. В основе структуры α-кварца лежат кремнекислородные тетраэдры, где вокруг каждого атома кремния приблизительно на одинаковых расстояниях находятся четыре атома кислорода, а каждый атом кислорода соединяет два тетраэдра, т.е. размещается между двумя атомами кремния. Тетраэдры соединены между собой вершинами.
Окраска кварца бывает самой различной, в связи с чем выделяют ряд минеральных разновидностей (табл. 7):
- горный хрусталь – бесцветный прозрачный кварц;
- аметист – фиолетовый прозрачный кварц;
- цитрин – желтый прозрачный кварц;
- раухтопаз – прозрачный дымчатый кварц;
- морион – непрозрачный, полупрозрачный кварц;
- розовый полупрозрачный кварц;
- молочный непрозрачный, полупрозрачный кварц.
Фиолетовый цвет кварца обусловлен изоморфной примесью Fe 3+ и внедрившимися в межузельные пространства катионами щелочных металлов. Цвет мориона обусловлен такой же примесью Al 3+ и катионами Na+ и Li+, а у цитрина – катионами Li+ и Н+. Розовый цвет кварца устойчив до температуры 3000 С и вызван примесью ионов Ti 3+. Молочный цвет кварца обусловлен микроскопическими включениями жидкостей и газов.
Цвет кварца также может быть обусловлен всевозможными включениями и псевдоморфозами:
- празем – непрозрачный зеленый кварц. Цвет обусловлен тонкими включениями актинолита или хлорита (рис. 32);
- авантюрин – буровато-красный кварц с мерцающим золотым отливом, за счет включений слюды, гётита или магнетита (табл. 7);
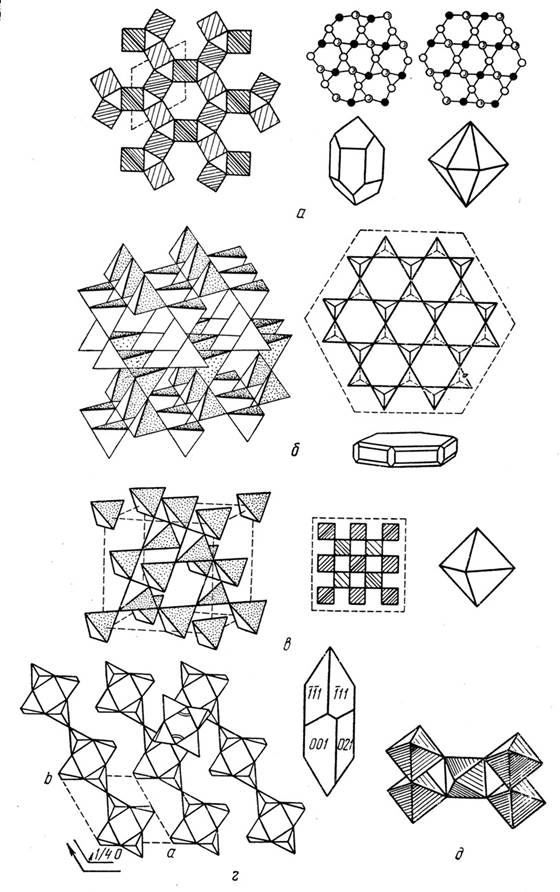
Рис. 31. Кристаллическая структура полиморфных модификаций кремнезема SiO2
(по Е.К. Лазаренко, 1971)
а – α-кварц и β-кварц, б – тридимит, в – кристобалит, г – коэсит, д – стишовит

Рис. 32 Празем. Сплошной агрегат

Рис. 33 Полированный образец тонковолокнистого кварца «соколиного глаза»

Рис. 34 Полированный образец тонковолокнистого кварца «тигрового глаза»

Рис. 35 Полированный образец тонковолокнистого кварца «кошачьего глаза»
- «соколиный глаз» - тонковолокнистый кварц синего цвета, образован-ный за счет силификации поперечно-волокнистых прожилков асбесто-видного минерала крокидолита. Первоначально крокидолит имеет синий цвет, и когда при инфильтрации кварца вдоль волокон этот цвет сохраняется, образуется так называемый «соколиный глаз» (рис. 33);
- «тигровый глаз» - тонковолокнистый кварц золотисто-коричневого или желтого цвета, образованный при окислении крокидолита до и после его замещения кварцем (иногда крокидолит представлен пустотелыми трубочками, которые могут заполняться гидроокислами железа) (рис. 34);
- «кошачий глаз» - тонковолокнистый кварц зеленого цвета, образован-ный за счет включений асбеста, либо за счет псевдоморфоз кварца по асбестовидным минералам группы амфиболов (рис. 35).
Скрытокристаллической волокнистой, радиально-концентрической, либо слоисто-концентрической разновидностью кварца является халцедон (табл. 8). По цвету и строению выделяют несколько его минеральных разновидностей:
- халцедон – серый, голубовато-серый;
- хризопраз – зеленый, яблочно-зеленый;
- карнеол – оранжево-красный до темного;
- сердолик – бледно-розовый до мясо-красного;
- гелиотроп – зеленый с ярко-красными пятнами;
- агат – различно окрашенный халцедон, часто полупрозрачный с чере-дующимися концентрическими светлыми и темными полосами;
- сардоникс – коричневато-красный и белый, полосчатый;
- оникс – черный и белый с чередующимися полосами.
Происхождение кварца и халцедона связано с кислыми интрузивными и эффузивными породами, пегматитами, гидротермальными жилами и контактово-метасоматическими породами (скарнами, грейзенами). Кварц и халцедон могут образовываться и в экзогенных условиях путем дегидратации и раскисталлизации опала (геля кремнезема), при метаморфических процессах путем обезвоживания опалсодержащих осадочных пород. Происхождение кварца, обладающего пьезоэлектрическими свойствами, связано с «альпийскими жилами», образующимися в линзовидных трещинах при метаморфизме и рассланцевании горных пород. В жилах «альпийского типа» кристаллы кварца могут достигать больших размеров.
Происхождение окислов и гидроокислов связано, главным образом, с экзогенными процессами. Образование окислов и гидроокислов происходит в корах выветривания, зонах окисления различных минеральных месторождений, а также в водных условиях, где формируются гидроокислы железа, марганца и алюминия.
В эндогенных условиях (магматических, гидротермальных, реже метаморфических) образуются лишь некоторые простые и сложные окислы (рутил, ильменит, магнетит, кварц, касситерит).
Карбонаты
Карбонаты – соединения катионов с анионным комплексом [СО3] 2- (соли угольной кислоты). Наиболее распространенными катионами являются Ca, Na, Mg, Cu, Fe.
С химической точки зрения карбонаты делят на несколько классов:
- безводные карбонаты – соединения одного или нескольких катионов с анионным комплексом [СО3] 2- (кальцит, арагонит, сидерит, магнезит, доло-мит, родохрозит);
- сложные карбонаты – соединения катионов с анионным комплексом и добавочными анионами (ОН) -, F -, Cl - (малахит, азурит).
Общая характеристика. В основе структуры карбонатов лежат плоские группы [СО3] 2-, в которых катион углерода симметрично окружен тремя ионами кислорода, размещенными в вершинах равностороннего треугольника. У кальцита все анионные группировки ориентированы параллельно друг другу, обусловливая резкую анизотропию строения кристаллической решетки минерала. А потому для бесцветных кристаллов кальцита характерно двойное светопреломление (рис. 36).
Карбонаты кристаллизуются в низших сингониях, главным образом, в ромбической, моноклинной, реже в средней сингонии – тригональной. У карбонатов тригональной сингонии отмечается совершенная спайность по ромбоэдру, такие карбонаты называют шпатами (исландский шпат, железный шпат, магнезиальный шпат). В исландском шпате по трещинам спайности наблюдается иризация (рис. 37).
В природе карбонаты встречаются в виде массивных, зернистых агрегатов, и в виде хорошо образованных кристаллов, реже в виде натечных масс (рис. 38). Окраска карбонатов, как правило, светлая: белая, серая, желтая, розовая. Исключение составляют карбонаты меди, они окрашены в зеленые и синие цвета. Твердость карбонатов обычно не превышает 5.
Важным диагностическим признаком карбонатов является вскипание под действием HCl и HNO3 с выделением углекислого газа.
Краткая характеристика карбонатов приведена в таблице № 9.
Происхождение карбонатов, как правило, экзогенное. Большинство карбонатов имеют осадочное хемогенное происхождение (кальцит, арагонит, доломит, сидерит). Кальцит и арагонит, слагающие раковины моллюсков и кости животных имеют биогенное происхождение. Арагонит также образуется в карстовых пещерах, образуя различные натечные тела (сталактиты, сталагмиты, пласты).
С зонами окисления медно-сульфидных месторождений связано образование малахита, азурита и арагонита.
В эндогенных условиях формирование карбонатов связано с низко-температурными гидротермальными жилами (кальцит, доломит, магнезит) и скарнами. Кальцит часто связан с продуктами регионального метаморфизма – мраморами, образованными за счет перекристаллизации известняков.

Рис. 36 Двойное светопреломление в кристалле кальцита

Рис. 37 Эффект иризации по трещине спайности в кристалле кальцита


Рис. 38 Натечные агрегаты карстовых пещер.
Полированные образцы мраморных ониксов
Сульфаты
Сульфаты – соединения катионов с анионным комплексом [SO4] 2- (соли серной кислоты). Главными катионами сульфатов являются Fe3+, Na, K, Al, Ca, Ba.
С химической точки зрения сульфаты делят на несколько классов:
- безводные сульфаты – соединения катионов с анионным комплексом [SO4] 2- (ангидрит, барит, целестин);
- водные сульфаты – соединения катионов с анионным комплексом [SO4] 2- и молекулой Н2О (гипс, гипс-селенит);
- сложные сульфаты - соединения катионов с анионным комплексом [SO4] 2- и добавочными анионами (ОН) – (алунит).
Общая характеристика. Основой структуры сульфатов является анионная группа [SO4] 2-, в которой ионы кислорода тетраэдрически окружают шестивалентный ион серы. В общую структуру такие группы соединяются с помощью добавочных катионов, анионов или молекул воды. Кристаллизуются сульфаты в низших сингониях, в моноклинной и ромбической.
Структура водного сульфата – гипса является более сложной. В ней два листа анионных групп [SO4] 2- , тесно связанные с ионами, образуют двойные слои, между которыми размещаются молекулы воды. Слоистое строение гипса обусловливает его физические свойства, совершенную спайность, проходящую между этими слоями, низкую твердость (1,5) и низкую плотность (2,3 г/см3).
В природе сульфаты встречаются в виде хорошо образованных кристаллов, друз, волокнистых, лучистых, зернистых, реже сплошных агрегатов. Они имеют светлую окраску (желтоватую, зеленоватую, белую, серую) или бесцветны. Блеск сульфатов стеклянный, шелковистый. Твердость у безводных сульфатов 3,0 – 3,5, а у водных – 1,5. Спайность, как правило, совершенная в трех направлениях, из-за чего многие сульфаты называют шпатами (тяжелый шпат - барит, легкий шпат - гипс).
Краткая характеристика сульфатов приведена в таблице № 10.
Происхождение сульфатов в основном осадочное хемогенное. Гипсы и ангидриты выпадают из истинных растворов на дне морских водоемов. Целестин встречается в виде жеод и секреций в пустотах, образовавшихся в результате частичного растворения осадочных пород (доломитов, известня-ков, гипсоносных глин, мергелей) (рис. 39).
Барит образуется эндогенным путем в гидротермальных средне- и низкотемпературных жилах в ассоциации с флюоритом, кальцитом и некоторыми сульфидами (рис. 40). Ангидрит иногда ассоциирует с некоторыми метаморфическими и метаморфизованными породами.
Фосфаты
Фосфаты – соединение катионов с анионным комплексом [РО4] 3- (соли фосфорной кислоты). Наиболее распространенными катионами являются Fe, Al, Ca, Mn, U, Na.
С химической точки зрения фосфаты делят на несколько классов:
- безводные фосфаты - соединение катионов с анионным комплексом [РО4] 3- (апатит, монацит);
- водные фосфаты - соединение катионов с анионным комплексом [РО4] 3- и молекулами Н2О (бирюза, урановые слюдки).
Общая характеристика. Основой структуры фосфатов являются тетраэдрические радикалы [РО4] 3-, состоящие из четырех атомов кислорода, расположенных вокруг центрального катиона Р 5+. Кислороднофосфорные радикалы связаны между собой посредством катионов. Кристаллизуются фосфаты в низших сингониях, в ромбической и моноклинной.
Структура водных фосфатов – урановых слюдок состоит из тетра-гональных гофрированных сеток [UO2(PO4)] 2-. Между сетками распола-

Рис. 39 Жеоды кристаллов целестина, заполняющие пустоту в осадочной породе

Рис. 40 Гидротермальный низкотемпературный барит в ассоциации с флюоритом (перьевидные сростки кристаллов барита с октаэдрическими кристаллами флюорита)
гаются молекулы Н2О. Объединяются сетки в общую структуру при помощи катионов. Сетчатое (слоистое) строение урановых слюдок обусловливает их совершенную спайность и низкую твердость (2,0 – 2,5), а также уплощенный, таблитчатый, реже изометричный облик кристаллов.
Фосфаты образуют как отдельные удлиненно-призматические, игольчатые и пластинчатые кристаллы (апатит), так и различные зернистые, волокнистые, лучистые агрегаты, корки и примазки (бирюза).
Окраска фосфатов пестрая, обычно оттенки синего, желтого и зеленого цветов. Значения твердости (от 2,0 до 6,0) и плотности (2,5 – 3,5 г/см3) варьируют зависимости от состава.
Краткая характеристика фосфатов приведена в таблице № 11.
Происхождение фосфатов экзогенное. Осадочные биохемогенные месторождения фосфатов называют фосфоритами, они сложены, как правило, тонкодисперсным апатитом и кальцитом.
Образование бирюзы происходит при взаимодействии поверхностных вод с глиноземистыми, изверженными и осадочными породами.
Апатит может быть как экзогенным, так и эндогенным. Крупные место-рождения этого минерала связаны не только осадочными, но и с щелочными изверженными породами.
Урановые слюдки являются достаточно редкими минералами. Они образуются в зоне окисления гидротермальных и осадочных месторождений, а также встречаются в ураноносных пегматитах.
Рекомендуемая литература:
8. Бетехтин А.Г. Минералогия. М.: Изд-во геологической литературы, 1950. 956 с.
9. Булах А.Г. Общая минералогия. СПб: Изд-во С.-Петербургского университета, 1999. 356 с. Годовиков А.А., Рипинен О.И., Моторин С.Г. Агаты. М.: Недра, 1987. 368 с.
10. Корнилов Н.И., Солодова Ю.П. Ювелирные камни. М.: Недра, 1986. 282 с.
11. Лазаренко Е.К. Курс минералогии. М.: Высшая школа, 1971. 608 с.
12. Миловский А.В. Минералогия и петрография. М.: Недра, 1985. 432с.
13. О'Доноху М. Кварц. М.: Мир, 1990. 136 с.
14. Самсонов Я.П., Туринге А.П. Самоцветы СССР. М.: Недра, 1985. 335 с.
Дата добавления: 2019-09-30; просмотров: 1435;











