Анатомия и физиология молочной железы
Молочная (грудная) железа (mamma) – парная апокрннная железа эпидермального происхождения, продуцирующая специфический секрет (молоко).
В норме у человека имеется одна пара молочных желез. В качестве атавизма встречаются добавочные молочные железы, которые могут располагаться в передне‑подмышечной области или на животе, нередко только с одной стороны; сосок и ареола при этом могут отсутствовать. У мужчин грудная железа остается в рудиментарном виде на всю жизнь, у женщин же с началом полового созревания она увеличивается в размерах. Молочные железы в своем развитии проходят несколько этапов. После рождения грудные железы у девочек и у мальчиков практически не отличаются друг от друга. В период полового созревания, с началом функционирования яичников, молочные железы начинают увеличиваться в объеме, а с наступлением менструаций их ткань подвергается ежемесячным циклическим изменениям в соответствии с фазами менструального цикла. К периоду менопаузы железы подвергаются инволютивным изменениям – жировому перерождению. Наибольшего своего развития молочная железа достигает к концу беременности, хотя продукция молока (лактация) происходит уже в послеродовом периоде.
Молочная железа располагается кпереди от фасции большой грудной мышцы, с которой она связана рыхлой соединительной тканью, обусловливающей ее подвижность. Через всю толщу железы проходят поддерживающие связки (связки Купера), отходящие от поверхностной фасции, из листков которой сформирована капсула самой железы, и вплетающиеся в глубокие слои кожи. У женщин железы располагаются симметрично на обеих сторонах передней поверхности грудной клетки от III до VI ребра, доходя медиально до края грудины, а латерально – до средней подмышечной линии. Несколько книзу от центра железы на ее передней поверхности находится сосок, papilla mammae, на верхушке которого открываются главные млечные ходы. Сосок окружен пигментированным участком кожи – околососковым кружком, areola mammae. В области ареолы и соска имеются циркулярные и продольные мышечные волокна, при сокращении которых сосок напрягается, чем облегчается эвакуация секрета при кормлении ребенка.
Молочная железа по типу своего строения относится к сложным альвеолярно‑трубчатым железам. Собственно ткань железы состоит из 15–20 конусообразных обособленных долек, которые сходятся радиально своими верхушками к соску. Выводные протоки каждой из долек соединяются в млечный ход, который направляется к соску и оканчивается на его верхушке небольшим отдельным для каждой дольки отверстием. В ретроареолярной области млечные протоки имеют ампулообразные расширения, служащие в период лактации своего рода резервуарами для молока, выделяемого в перерывах между кормлениями.
Кровоснабжение молочных желез осуществляется из аа. intercostales posteriores, a. thoracica interna и a. thoracica lateralis. Венозный отток от ткани железы происходит в бассейн верхней полой вены по сосудам, которые частью сопровождают названные артерии, частью идут под кожей, образуя сеть с широкими петлями.
Лимфоотток от ткани молочной железы осуществляется по нескольким путям, что определяет значительную вариабельность зон лимфогенного метастазирования. Регионарными для молочной железы являются следующие лимфатические узлы (рис. 1).
Подмышечные: интерпекторальные лимфатические узлы (Роттера) и лимфатические узлы, располагающиеся вдоль подмышечной вены и ее притоков. По этим путям происходит отток большей части лимфы (более 90 %). В соответствии с классификацией Международного противоракового союза 2002 года интрамаммарные лимфатические узлы также кодируются как подмышечные.
Они подразделяются на 3 уровня.
I уровень – (нижние подмышечные): лимфатические узлы, расположенные латерально по отношению к латеральной границе малой грудной мышцы.
II уровень – (средние подмышечные): лимфатические узлы, расположенные между медиальным и латеральным краями малой грудной мышцы, а также интерпекторальные лимфатические узлы (лимфатические узлы Роттера).
III уровень – (верхние подмышечные): лимфатические узлы, расположенные медиально по отношению к медиальному краю малой грудной мышцы, включая подключичные и апикальные.
Внутренние лимфатические узлы молочной железы (на стороне поражения): парастернальные лимфатические узлы, располагающиеся в эндоторакальной фасции и межреберных пространствах вдоль края грудины.
Остальная часть лимфо‑оттока от молочной железы может осуществляться, минуя регионарные лимфоузлы: по межреберному пути; по кожным, подкожным и позадигрудинным лимфатическим сосудам в лимфатическую систему противоположной железы (перекрестный путь метастазирования); через лимфатические сосуды области эпигастрия и далее – в лимфатическиеузлыкоронарной связки печени, забрюшинные и паховые лимфатические узлы (путь Героты).
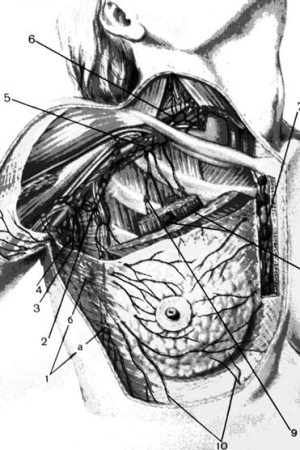
Рис. 1. Лимфатические сосуды и регионарные лимфатические узлы молочной железы. 1 –парамаммарные лимфатические узлы: а – узел Бартельса, 6 – узел Соргиуса; 2 – латеральные подмышечные узлы; 3 – центральные подмышечные лимфатические узлы; 4 – подлопаточные лимфатические узлы; 5 –подключичные лимфатические узлы; 6 –надключичные лимфатические узлы; 8 – межгрудные лимфатические узлы; 9 – позадигрудинные лимфатические узлы; 10 – лимфатические сосуды, направленные в эпигастральную область. (Приводится по: Атлас онкологических операций. Ред. Б.Е. Петерсон. М., 1987)
Распространение опухолевых клеток по этим путям создает предпосылки к возникновению в соответствующих группах лимфатических узлов отдаленных лимфогенных метастазов (рис. 2). Чувствительные нервы железа получает от II–V nn. intercostales. В иннервации кожи, покрывающей железу, принимают участие также ветви nn. pectorales mediales et laterales из плечевого сплетения и nn. supraclaviculares из шейного сплетения. Симпатические нервы проникают в железу вместе с сосудами.
Состояние и функционирование молочных желез на протяжении всей жизни женщины регулируются с помощью различных гормонов, продуцируемых железами внутренней секреции (яичники, надпочечники, питуитарная система гипофиза, гипоталамус). Большинство этих гормонов являются стероидными и имеют одного и того же предшественника – холестерол. Гормональная регуляция представляет собой сложный механизм эндокринных взаимодействий, осуществляющихся по принципу обратной связи. С наступлением половой зрелости в женском организме происходит повышение концентрации эстрогенов, что обусловливает рост и функциональное созревание молочных желез. Развитие тканей молочной железы и их функция регулируются женскими половыми гормонами (эстрогенами, прогестероном), а также хорионическим гонадотропином, пролактином. Особое значение в стимуляции развития ткани молочной железы и других женских вторичных половых признаков придается эстрогенам, продукция которых осуществляется в основном в яичниках в течение всего детородного периода. В ходе каждого менструального цикла ткани молочной железы претерпевают циклические изменения: после наступления овуляции, под воздействием вырабатываемого желтым телом прогестерона стимулируется рост альвеол, и размеры железы несколько увеличиваются. Если беременность не наступила, то после менструации уровень продукции прогестерона резко снижается, уменьшаются и размеры молочной железы. После этого в яичниках происходит созревание нового граафова пузырька, постепенно возрастает уровень продуцируемых в яичниках эстрогенов, что приводит к следующей овуляции, и цикл повторяется.
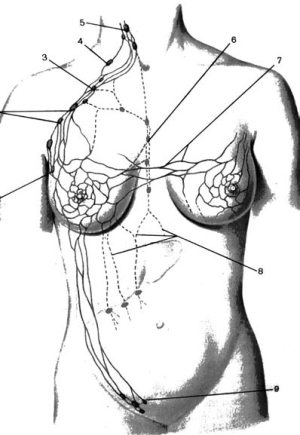
Рис. 2. Пути оттока лимфы от молочной железы (схема). 1 – парамаммарные лимфатические узлы; 2 – центральные подмышечные лимфатические узлы; 3 –подключичные лимфатические узлы; 4 –надключичные лимфатические узлы; 5 – глубокие шейные лимфатические узлы; 6 – парастернальные лимфатические узллы; 7 –перекрестные лимфатические пути, соединяющие лимфатические системы обеих молочных желез; 8 – лимфатические сосуды, идущие в брюшную полость; 9 – поверхностные паховые лимфатические узлы. (Приводится по: Атлас онкологических операций. Ред. Б.Е. Петерсон. М., 1987)
Уровень половых гормонов претерпевает естественные физиологические колебания не только во время каждого менструального цикла, но и при беременности, родах, грудном вскармливании. В регуляции этого процесса важное значение имеет нормальное функционирование практически всех гормональных органов, а также систем, отвечающих за инактивацию и выведение гормонов (почки, печень). Клинические данные говорят о том, что при отклонениях в интенсивности и сроках действия этих физиологических механизмов риск заболевания раком молочной железы повышается. Частичная инволюция молочных желез с наступлением менопаузы связана с прекращением функционирования яичников, являющихся основными продуцентами эстрогенов у женщин детородного возраста. Однако и после прекращения менструаций в организме женщины образуется некоторое количество эстрогенов – в надпочечниках, а также за счет ароматизации андрогенов в жировой ткани, мышцах, внутренних органах.
Фиброаденоматоз
Фиброаденоматоз (ФАМ) молочных желез – весьма частая патология, которая встречается, по данным разных авторов, у 30–60 % всех женщин. В 1984 г. ВОЗ предложила для этой патологии термин фиброзно‑кистозная болезнь молочных желез. В Международной классификации болезней (X) данная нозологическая форма обозначается как доброкачественная дисплазия молочных желез. В зарубежной литературе часто используется термин «доброкачественная болезнь груди». В отечественной литературе обычно применяют термины ФАМ, дисгормональная гиперплазия молочных желез, мастопатия. В 1985 г. Минздрав России предложил удобную клинико‑рентгенологическую классификацию мастопатии, которая чаще всего применяется в настоящее время. Мастопатия, по этой классификации, делится на 2 основные формы, каждая из которых имеет подтипы. В частности, выделяют:
1) диффузную мастопатию:
а) с преобладанием железистого компонента (аденоз);
б) с преобладанием фиброзного компонента (фиброз);
в) с преобладанием кистозного компонента (множественные кисты);
г) смешанная форма (железисто‑кистозная).
2) узловую мастопатию:
а) фиброаденома;
б) киста.
В онкологической практике чаще применяют термин ФАМ, который и будет использоваться далее. При ФАМ больные обычно предъявляют жалобы на масталгию (боли в молочных железах), синдром предменструального напряжения (тяжесть и набухание молочных желез в предменструальный период), дисальгоменорею (болезненные, бессистемные месячные). При пальпации выявляют уплотнения и отек в молочных железах; при эхографическом и маммографическом исследованиях – кисты и фиброаденоматозные изменения; при морфологическом исследовании – гиперплазию эпителиальных клеток и фибробластов в дольковых и протоковых структурах молочных желез, склерозирование и атрофию.
Проблема ФАМ является очень актуальной, так как, по данным опросов, на амбулаторном приеме онколога до 50 % больных составляют пациентки с данной патологией. ФАМ как отдельная нозологическая единица был выделен в конце XIX века, и несколько десятилетий это заболевание рассматривалось как этап, предшествующий возникновению рака молочной железы. В настоящее время взгляды на ФАМ претерпели существенные изменения. В целом данная патология не является предраком или стадией онкологического процесса в молочных железах. Предрак молочных желез – морфологическое понятие, к нему относят протоковую атипичную гиперплазию эпителия и карциному in situ , дольковую атипичную гиперплазию эпителия и карциному in situ ; при наличии этих изменений риск инвазивного рака молочной железы (РМЖ) повышается в 2,5‑10 раз и более. ФАМ же рассматривают как один из многочисленных факторов риска возникновения РМЖ. Предраковые изменения обнаруживают лишь у небольшой части женщин, страдающих ФАМ. Однако не следует и недооценивать роль ФАМ в развитии РМЖ.
Существуют 4 группы доказательств связи ФАМ с РМЖ:
1) у ФАМ и РМЖ – общие факторы риска;
2) причины и механизмы развития ФАМ и РМЖ имеют общие черты, ключевую роль при этом играет относительный или абсолютный избыток эстрогенов – длительная хроническая гиперэстрогения;
3) при удалении молочных желез в связи с раковой опухолью в тканях нередко можно обнаружить различные морфологические проявления ФАМ;
4) в ретроспективных и проспективных эпидемиологических исследованиях у больных РМЖ чаще выявляют предшествующий ФАМ. Тем не менее вопрос о взаимоотношениях ФАМ и РМЖ является противоречивым. По данным разных авторов, ФАМ может повышать риск развития РМЖ в 1,5 раза или вовсе не влиять на него. Всех женщин, страдающих ФАМ, нельзя относить в группу риска развития РМЖ. Наиболее существенное значение при этом имеют морфологические изменения ткани молочных желез. По данным эпидемиологических исследований, у больных с ФАМ при гиперпролиферации эпителия без атипии риск развития рака повышается в 2–3 раза, при гиперпролиферации эпителия с атипией – в 5–7 раз. Наблюдение за женщинами, страдающими ФАМ, и проведение терапии этого заболевания направлено на профилактику рака молочной железы. Однако научные и практические аспекты проблемы ФАМ продолжают оставаться дискуссионными в онкологии. К тому же современная медицина просто не имеет технических возможностей осуществлять адекватное наблюдение и проводить лечение огромного контингента женщин, страдающих ФАМ. К сожалению, в нашей стране усилия онкологической службы, направленные на выявление, лечение и диспансеризацию пациенток с ФАМ, не привели к поставленной цели – снижению заболеваемости РМЖ.
При узловых формах ФАМ показана секторальная резекция молочной железы со срочным гистологическим исследованием макропрепарата. Двумя полуовальными разрезами в радиальном направлении по отношению к ареоле иссекают пораженный сектор железы до фасции большой грудной мышцы, а затем послойно зашивают рану (рис. 3).
В зависимости от результатов срочного гистологического исследования операцию на этом либо заканчивают, если процесс доброкачественный, либо (при обнаружении рака) расширяют до объема радикальной операции.
Диффузные формы ФАМ подлежат консервативному лечению, которое направлено на регуляцию нарушений функций желез внутренней секреции, лечение заболеваний женских половых органов, подавлению пролиферативных процессов в молочной железе.
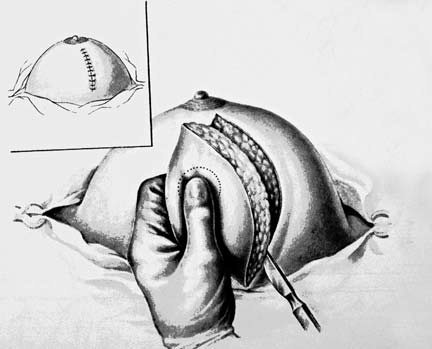
Рис. 3. Иссечение сектора молочной железы. (Приводится по: Атлас онкологических операций. Ред. Б.Е. Петерсон. М., 1987)
Для снятия болевого синдрома применяют электрофорез с новокаином и йодидом калия. Для уменьшения пролиферативных процессов в молочной железе у женщин до 40 лет рекомендуют лечение микродозами йода (водный раствор 0,25 % йодида калия в течение межменструального периода по 10 мл 1 раз в день после еды в течение 1 года). Применение микродоз йода основано на стимуляции выработки лютеинизирующего гормона гипофизом. Этот гормон нормализует функцию яичников с нарушенной лютеиновой фазой и восстанавливает нормальную цикличность изменений в молочной железе. При недостаточности функции желтого тела во второй половине менструального цикла применяют прогестерон.
Дата добавления: 2016-12-16; просмотров: 3634;











