ОБЩИЕ ЗАКОНОМЕРНОСТИ В ИЗМЕНЕНИИ АТОМНЫХ РАДИУСОВ, ЭНЕРГИИ ИОНИЗАЦИИ, ЭНЕРГИИ СРОДСТВА К ЭЛЕКТРОНУ И ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ В ПЕРИОДАХ И ГРУППАХ
Периодический закон указывает на периодический характер функцио-нальной зависимости свойств элементов от заряда ядра их атома. Химическая природа элемента обусловлена его способностью терять или приобретать электроны. Количественно эта способность может быть оценена энергией ионизации и энергией сродства к электрону.
Энергия, необходимая для отрыва электрона от нейтрального атома или иона, называется энергией ионизации. Выражают эту энергию в электрон/вольтах и обозначают I. Расчеты I обычно ведут на 1 моль вещества и в этом случае применяют размерности Дж/моль или кДж/моль.
Для многоэлектронных атомов для каждого электрона существует своя величина энергии ионизации. При этом они соотносятся следующим образом:
/1 </2</3 ...</.
Энергия ионизации периодически изменяется в соответствии с изменением зарядов ядер элементов.
В периодах с ростом заряда ядра энергия ионизации увеличивается.
В главных подгруппах с ростом заряда ядра энергия ионизации уменьшается , в побочных - увеличивается.
Энергия ионизации является мерой металличности элементов, чем она меньше, тем в большей степени элемент проявляет металлические свойства . Наименьшей энергией ионизации обладает франций, наибольшей - фтор.
Энергия сродства к электрону это та энергия, которая выделяется при присоединении электрона к нейтральному атому:
Э° + e = Э- + Fср; Fср =[кДж/моль] или [эВ/атом].
В периодах с ростом заряда ядра энергия сродства к электрону уве-личивается . В главных подгруппах сверху вниз она уменьшается .
Энергия сродства к электрону является мерой неметалличности: чем она больше, тем в большей степени элемент проявляет неметаллические свойства. Наибольшее значение ее наблюдается у фтора.
Электроотрицательность характеризует способность атома оттяги-вать на себя электронную плотность при образовании химических связей.ПоПолингу она равна полусумме энергии ионизации и энергии сродства к электрону.
В периодах с ростом заряда ядра электроотрицательность увеличивается , в подгруппах - сверху вниз уменьшается для элементов главных подгрупп и увеличивается для элементов побочных подгрупп. Чем больше элек-троотрицательность элемента, тем сильнее выражены его неметаллические свойства.
Следует отметить, что по периодам и группам изменение данных характеристик не всегда монотонно, наблюдается вторичная периодичность, что связано с эффектами экранирования, проникновения электронов к ядру, лантаноидным сжатием.
Эффект экранирования состоит в уменьшении воздействия на элект-роны положительного заряда ядра, что обусловлено наличием между рас-сматриваемыми электронами и ядром других электронов.
Эффект проникновения электронов к ядру обусловлен тем, что сог-ласно квантовой механике электрон может находится в любой точке вокруг ядра, поэтому даже внешние электроны какой то момент времени находится в области близкой к ядру, где мало проявляется экранирующее действие. Это приводит к увеличению связи внешних электронов с ядром.
Одной из важнейших характеристик атомов и ионов является их ради-ус. Вследствие волнового характера движения атомы не имеют строго очер-ченных границ , поэтому за радиус свободного атома принимают теоре-тически рассчитанное положение главного максимума плотности внешних электронных облаков. Это, так называемые, орбитальные радиусы. Практи-чески приходится иметь дело с радиусами атомов, связанных друг с другом тем или иным типом химической связи, такие радиусы называются эффек-тивными.
В периодах, с ростом заряда ядра, эффективный атомный радиус уменьшается, так как число энергетических уровней остается постоянным, а заряд ядра растет, что приводит к увеличивается силы притяжения электро-нов к ядру.
В главных подгруппах величины радиусов атомов увеличиваются сверху вниз, так как растет число энергетических уровней , что ослабляет силы притяжения электронов к ядру.
В побочных подгруппах при переходе от первого элемента ко второму радиус незначительно увеличиваются, а при переходе от второго элемента к третьему остается постоянным, но в целом можно сказать, что радиусы атомов увеличиваются.
Из этого следует, что в периодах слева направо металлические свойства элементов ослабевают, т.е. ослабевают восстановительные свойства и усиливаются окислительные свойства
В главных подгруппах металлические свойства сверху вниз увеличива-ются, неметаллические -уменьшаются. В побочных подгруппах металличес-кие свойства уменьшаются.
Периодичность в свойствах, связанная с изменениями строения элект-ронных оболочек, наблюдается и среди однотипных соединений простых веществ.
Все неорганические вещества можно разделить на классы. Классы-
это группы веществ, близких по составу и свойствам. .
Оксиды - это сложные вещества, состоящие из атомов двух элемен-тов, один из которых кислород в степени окисления -2. Оксиды делятся на солееобразующие ( основные, кислотные , амфотерные ) и несолеобразую-щие (безразличные).
Безразличные оксиды – это обычно оксиды неметаллов в низших положительных степенях окисления, например: CO, NO, N2O . Эти оксиды не взаимодействуют с водой, не образуют гидроксиды.
Основные оксиды образуют металлы в степенях окисления +1 и +2 ( исключения BeO, ZnO , SnO, PbO) . Например: K2O, CaO, FeO.
Кислотные оксиды образуюм неметаллы во всех степенях окисления и металлы в степенях окисления + 5, + 6,+ 7 . При взаимодействии с водой они образуют кислотные гидроксиды . Например, SO2, SO3, P2O5, FeO3, Mn2O7.
Амфотерные оксиды- это оксиды металлов в степенях окисления +3 и +4 например:, Al2O3,Cr2O3.
Номенклатура оксидов и гидроксидов строится по названию центрально-го атома с указанием его степени окисления для многовалентных атомов. Применяется и тривиальная номенклатура (система случайных и традицион-ных названий). Например :
K2O- оксид калия, Mn2O7 - оксид марганца(VII), H2Cr2O7 – гидроксид хро-ма (VI), дихромовая кислота, H2SO4 – гидроксид серы (VI), серная кислота,
Са(ОН)2 – гидроксид кальция.
Если центральный атом в кислотном гидроксиде имеет несколько степеней окисления, то применяют окончания -истая и – ная:
S -2 0 +2 +4 +6
H2SO3 H2SO4
H2SO3 – сернистая кислота (промежуточная степень окисления серы),
H2SO4 - серная кислота (высшая степень окисления серы).
Если центральный атом имеет несколько степеней окисления, то применя-ют и другие окончания:
HClO – хлорноватистая кислота, HClO2 – хлористая кислота , HClO3 –хлор-новатая кислота, HClO4 – хлорная кислота.
Кроме гидроксидов - кислот существуют и бескислородные кислоты, которые гидроксидами не являются, например : HI – йодоводородная кислота, H2S – сероводородная кислота.
Число атомов водорода в молекуле кислоты не всегда указывает на её ос-новность, Замещаться могут только те атомы водорода, которые соединены с центральным атомом через кислород . Например, фосфористая кислота явля-ется двухосновной:

 H O
H O
 H - O - P = O H3PO3 + 2NaOH = Na2HPO3 + 2H2O
H - O - P = O H3PO3 + 2NaOH = Na2HPO3 + 2H2O
 H Na2HPO3 – средняя соль
H Na2HPO3 – средняя соль
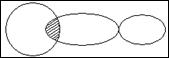
Амфотерные гидроксиды занимают по своей природе промежуточное положение между кислотами и основаниями. При взаимодействии с кислотами они выполняют роль основания, а при взаимодействии с основаниями – роли кислоты.
Соли – Это продукты взаимодействия оксидов и гидроксидов различной природы.
При взаимодействии амфотерных гидроксидов с кислотами образу-ются соли катионного типа, а при взаимодействии с основаниями – анион-ного.
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O,
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O,
Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4] ,
В зависимости от соотношения реагирующих гидроксидов могут получиться средние , кислые и основные соли.
В зависимости от степени окисления центрального атома в составе аниона анионы имеют следующие окончания - ид – низшая степень окисления , -ит - средняя, - ат – высшая. Например :
-2 +4 +6
S-2 SO32- SO42-
-ид -ит -ат
K2S – сульфид калия K2SO3 – сульфит калия K2SO4 – сульфат калия
Кислые соли – это продукты неполной нейтрализации многоосновных кислот: H3PO4 + KOH = KH2PO4 + H2O
H3PO4 + 2KOH = K2HPO4 + 2H2O
Кислые соли в своём большинстве являются растворимыми. Называют
кислые соли, добавляя к названию аниона приставку “гидро”, например :
K2HPO4 – гидрофосфат калия, KH2PO4 – дигидрофосфат калия
Основные соли – это продукты неполной нейтрализации многокислот-ных оснований:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Fe(OH)3 + 2HCl = FeOHCl2 + 2H2O
В большинстве своем основные соли (кроме нитратов) – нерастворимые соединения. Название этих солей строится по названию аниона и названию катиона в родительном падеже с указанием степени окисления, если у соответсвующего им металла их несколько.
Проанализируем изменение свойств оксидов и гидроксидов по периодам и группам на примере элементов третьего периода :
Na2O MgO Al2O3 SiO2 P2O5 S03 Cl2O7
NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3 PO4 H2SO4 HClO4
HAlO2
Основные свойства уменьшаются
Кислотные свойства увеличиваются
В главных подгруппах сверху вниз усиливается основной характер оксидов и гидроксидов, и уменьшается кислотный, например :
Be(OH)2 Mg(OH)2 Ca(OH)2 Sr(OH)2 Ba(OH)2
H2ВеO2
Основные свойства увеличиваются
HClO3 HBrO3 HlO3
Кислотные свойства уменьшаются
В побочных подгруппах сверху вниз основной характер оксидов и гидроксидов уменьшается.
В соответствии с правилом Косселя чем меньше радиус центрального атома и больше его заряд, тем сильнее гидроксид проявляет кислотные свойства и наоборот, чем больше радиус и меньше заряд, тем сильнее выражены основные свойства, например :
Cr(OH)2 Cr(OH)3 H2CrO4
основ. амфот. кислот.
Основные свойства уменьшаются
Кислотные свойства безкислородных кислот в главных подгруппах сверху вниз увеличиваются :
HF HCI HBr HI
Кислотные свойства увеличиваются
ХИМИЧЕСКАЯ СВЯЗЬ
Первые попытки объяснить причины образования химической связи предпринимались еще в Х1Х веке ‚ однако только на базе работ Косселя и Льюиса в 1916 году зародились фундаментальные гипотезы, которые в нас-тоящее время являются основой наших представлений о химической связи. Коссель и Льюис предположили‚ что образование химической связи связано с тем‚ что каждый атом стремится приобрести устойчивую электронную конфигурацию следующего за ним инертного газа. Образование этой элект-ронной конфигурации они объясняли по разному : Льюис говорил, что она образуется в результате обобществления электронов, т.е. за счет образования общих электронных пар, Коссель связывал ее образование с передачей элек-тронов от менее электроотрицательного атома более электроотрицательно-му, что приводило к дальнейшем взаимодействию образовавшихся ионов за счет сил электростатического притяжения. Таким образом, представления Льюиса объясняли образование ковалентной связи, Косселя – ионной.

 В зависимости от электроотрицательности атомов, образовавших химическую она делится на ковалентную неполярную ( = 0, где =|E1-E2 |
В зависимости от электроотрицательности атомов, образовавших химическую она делится на ковалентную неполярную ( = 0, где =|E1-E2 |
E1 и E2 - электроотрицательности атомов), ковалентную полярную
 ( < 2,0 ), ионную ( D >2,0). В этом случае электроны полностью смещаются к более электроотрицательному атому , свяазуется за счет сил электростатического притяжения разноименно заряженных ионов:
( < 2,0 ), ионную ( D >2,0). В этом случае электроны полностью смещаются к более электроотрицательному атому , свяазуется за счет сил электростатического притяжения разноименно заряженных ионов:



 Na× + Cl [Na]+ [ Cl ]-
Na× + Cl [Na]+ [ Cl ]-
Химическая связь характеризуется тремя параметрами – длина связи, угол связи и энергия связи. Длина связи – это равновесное расстояние между центрами ядер в молекуле. Она зависит от радиусов атома и кратности связи. Энергия связи - это та энергия, которую нужно затратить на разрыв связи, чем меньше длина и кратность связи, тем выше энергия связи. Угол связи – это угол между воображаемыми линиями, проведенными через центры атомов.
В 1927 году Гейтлер и Лондон решили уравнение Шреденгера для молекулы водорода, рассчитав энергию молекулы водорода для различных межатомных расстояний, они показали что возможно два решения уравнение Шреденгера - волновая функция , получившая название симметричной функции (спины атомов водорода антипараллельны) и волновая функция - , получившая название асимметричной функции ( спины атомов водорода паралельны) . В случае симметричной функции становится возможным передвижение электронов в поле обоих ядер, что приводит к значительному увеличению электронной плотности в пространстве между ядрами. Между ядрами появляется область с высокой плотностью отрицательного заряда, который стягивает положительно заряженные ядра. Притяжение уменьшает потенциальную энергию системы - возникает химическая связь, при этом сферы облаков не касаются друг друга, а перекрываются. Наоборот, когда спины параллельны плотность электронного облака в пространстве между ядрами падает до нуля, электроны выталкиваются из пространства между ядрами, химическая связь не образуется. Представления Гейтлера и Лондона о механизме образования химической связи послужили основой для разработки теории химической связи, получившей название метода валентных связей ( МВС).
Основные положения метода валентных связей :
1. Химическая связь образуется между двумя атомами с антипараллель- ными спинами, при этом происходит перекрывание волновых функций электронов, между атомами появляется зона с повышенной элект-ронной плотностью, что приводит к уменьшению потенциальную энергию системы.
2. Связь располагается в том направлении, в котором возможность перекрывания волновых функций электронов, образующих связь является наибольшей.
3. Из двух орбиталей атома наиболее прочную связь образует та, которая сильнее перекрывается с орбиталью другого атома.
4. Химическая связь носит локализованный характер.
Рассмотрим в рамках МВС свойства ковалентной связи – ее насыщае-мость, направленность и поляризуемость.
Насыщаемость.
Вследствие насыщаемости молекулы имеют определенный состав и существуют в виде частиц определенной структуры. Данное свойство ковалентной связи неразрывно связано с таким понятием как валентность. Валентность характеризует способность атома образовывать определенное число связей. Поскольку пребывание электрона в поле двух ядер энергетически выгоднее, чем в поле своего ядра в образовании химической связи принимают участие все одноэлектронные облака, т.е. ковалентность (валентность) определяется числом неспаренных электронов. Число неспаренных электронов может увеличиваться в результате возбуждения, при котором двухэлектронные облака распадаются на одноэлектронные. Однако возбуждение атомов до нового валентного состояния требует затраты определенной энергии, поэтому возбуждение возможно только в тех случаях, когда затрата энергии компенсируется энергией которая выделяется при образовании химических связей. Возбуждение возможно только в пределах своего энергетического уровня.
Например :
16S ... 3s23p4 __  — — — K = 2
— — — K = 2 
Так как сера является элементов третьего периода , то у атома имеются свободные орбитали на d- подуровне, на которые могут переходить спаренные электроны при возбуждении :
— — — — —
16S*... 3s23p33d1 — — — K = 4
— — — — — —
16S**... 3s13p33d2 — — —
— K = 6
8 О ... 2s22p4 __ — — — K = 2
В отличии от атома серы, атом кислорода возбудить нельзя, так как во втором энергетическом уровне только два подуровня.
Направленность
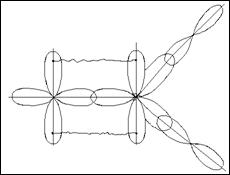
Квантово-механическое объяснение направленности химической связи основано на учете формы различных орбиталей, их перекрывание может осуществляться различными способами и зависит от способа перекрывания и симметрии образующегося электронного облака. Различают б-, p- и ∂- связи.
б-связи образуются при перекрывании электронных облаков вдоль линии соединения атомов.
p-связи образуются при перекрывании электронных облаков по обе стороны от линии, соединяющей центры атомов.
∂-связи образуются при перекрывании всех четырех лопастей d -орбиталей, расположенных в параллельных плоскостях.
s-электроны могут участвовать в образовании только б связей, р-орбитали - в б и p –связывании. Например :
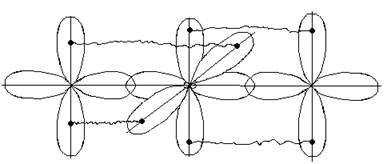
В молекулах с кратными связями одна связь сигма -, остальные - пи.
Геометрические формулы молекул
Рассмотрим строение простейших молекул на примере водородных со-единений элементов VII, VI, V и IV групп главных подгрупп .
HСl H - Сl
Определяем электронные конфигурации атомов
+17Cl0 …3s23p3 





 3p
3p

 K=1
K=1
 3s
3s

 1H 1s1 1s K=1
1H 1s1 1s K=1
молекула имеет линейную форму, угол связи равен 180°.

 2) Н2S Н — S
2) Н2S Н — S
Н









 16S…3s2 3p4 3p К=2
16S…3s2 3p4 3p К=2
3s

 1H 1S1 1S K=
1H 1S1 1S K=
Молекула имеет угловую форму, угол связи равен 900
РН3
Н

3) Н-Р-Н, Р








 15P…3s23p3 3p. 3p К=3
15P…3s23p3 3p. 3p К=3
3s

 1H 1S1 1S K=1
1H 1S1 1S K=1
Угол связи равен 90°, молекула имеет
форму пирамиды.
Гибридизация
Обычно атомы формируют связи за счет электронов разных подуровней. Несмотря на различие формы исходных орбиталей, образованные при этом связи равноценны. Теоретическое обоснование этого факта предложили Слейтер и Полинг. Они показали, что при расчете и истолковании химической связи, образованной разными орбиталями не очень сильно различающимися по энергии, их можно заменить тем же количеством одинаковых орбиталей, называемых гибридными. При гибридизации происходит выравнивание энергии и формы атомных орбиталей. Гибридные орбитали сильно вытянуты в одну сторону от ядра, что обеспечивает их более сильное перекрывание с орбиталями других атомов, а это приводит к образованию более прочной связи. Гибридизации способствует также то обстоятельство, что при гибридизации электроны в многоэлектронных атомах испытывают меньшее отталкивание друг от друга, s- и р –орбитали.
Условиями устойчивой гибридизации являются :
1. Близость энергии орбиталей, участвующих в гибридизации.
2. Достаточно высокая плотность орбиталей.
3. Высокая степень перекрывания электронных облаков.
Исходя из сказанного, склонность к гибридизации с ростом заряда ядра уменьшается и в периодах, и в группах.
Различают sp- , sp2 -, sp3 - гибридизацию.
Рассмотрим примеры различных видов гибридизации:
1) ВеС12 Сl ¾ Ве ¾ Сl

 4Ве...2s2 __ __ __
4Ве...2s2 __ __ __
 2s К=0
2s К=0

 4Ве*...2s12р1 2р ___ К=2
4Ве*...2s12р1 2р ___ К=2
 2s ___
2s ___
 sр-гибридизация
sр-гибридизация


17Cl…3s23p5 3p
 |
3s
К=1
 Молекула имеет линейную форму,
Молекула имеет линейную форму,
угол связи равен 180
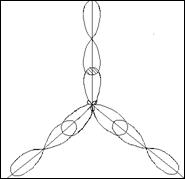
 2) ВCI3 Сl - В - Сl
2) ВCI3 Сl - В - Сl
Cl
 5В...2s22рI 2р ___ ___ ___
5В...2s22рI 2р ___ ___ ___
К=1

 2s ___
2s ___


 5В*… 2s12p2 2р ___ ___ ___ К=3
5В*… 2s12p2 2р ___ ___ ___ К=3
2s —
sр2 –гибридизация
Молекула имеет форму плоского треугольника, угол связи равен 120°
Н
 |
3) 
 СН4 Н С Н
СН4 Н С Н

Н
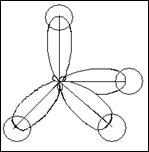

 6С…2s22р2 2р ___ ___ ___ K=2
6С…2s22р2 2р ___ ___ ___ K=2

 2 ___
2 ___
6С*…2s12p3


 2p ___ ___ ___ К=4
2p ___ ___ ___ К=4

2s ___
sр3 -гибридизация
Молекула имеет тетраэдрическую форму,
угол связи равен 1090 28/
Очень часто углы в молекулах не равны тем, которые мы рассматривали выше, это связано с тем , что на геометрическую форму молекул влияют несвязывающие электронные пары. Рассмотрим графические формулы молекул аммиака и воды.
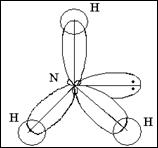
. . Молекула
NН3 Н-N -Н пирамидальная
½
H






 7N …2s22p3 2p
7N …2s22p3 2p


 2s
2s
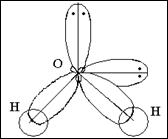
. .
Н2О Н ¾ O :
½
H









 8O …2s22p4 2p
8O …2s22p4 2p
2s
молекула угловая
ГЕОМЕТРИЧЕСКИЕ ФОРМЫ МОЛЕКУЛ С КРАТНЫМИ СВЯЗЯМИ
При определении геометрической формы таких молекул учитывают, что p-связи образуются только «чистыми» р-орбиталями, в этом случае образуются совмещённые конфигурации.
Например: COCl2
 Cl
Cl
O=С
 Cl
Cl

 6С… 2s22p2 2p __ __ __
6С… 2s22p2 2p __ __ __
 K=2
K=2
 2S ___
2S ___


 6C*…2s1p3 2p __ __ __
6C*…2s1p3 2p __ __ __
K=4
 2S ___
2S ___
Один из р-электронов образует p-связь, значит атом углерода находится в состоянии sp2 гибридизации. Молекула имеет линейную форму, угол связи равен 180°



 8O...2S2 2р4 2р ___ ____ ____
8O...2S2 2р4 2р ___ ____ ____
К=2
17Cl…3s23p5




 3p ___ ____ ____ K=1
3p ___ ____ ____ K=1

 3s ____
3s ____
Молекула имеет плоскую треугольную форму.
ПРИНЦИП ГИЛЛЕСПИ
Очень простой способ предсказания валентных углов был разработан Гиллеспи. В основе способа лежит модель отталкивания локализованных электронных пар. Для молекул и ионов с большей атомностью число осей симметрии можно определить по формуле :
n=n2e – nп ,
где n-число осей симметрии центрального атома;
n2e - число электронных пар у центрального атома;
nп, число Пи-связей у центрального атома. Например : Н2SO4


 Н — O O n = 6-2=4 форма молекулы тетраэдрическая
Н — O O n = 6-2=4 форма молекулы тетраэдрическая


 S
S
Н — O O
Поляризуемость
Связь между атомами различных элементов всегда более или менее полярна. Для характеристики реакционной способности молекул необходимо знать не только исходное распределение плотности электронных облаков , но и легкость с которой оно изменяется. Мерой последней является поляризуе-мость. Поляризуемость -это способность связи становится полярной под действием внешнего поля.
РАСТВОРЫ
Растворами называются гомогенные системы, состоящие из двух или более компонентов и продуктов их взаимодействия. Растворение веществ в воде- это физико-химический процесс, при котором под влиянием молекул растворителя в растворенном веществе разрываются связи между частицами и образуются химические соединения растворяемого вещества и раствори-теля (сольваты и гидраты, если растворитель вода). Затем гидратированные частицы равномерно распределяются по всему объему раствора.
Растворение может быть как эндотермическим, так и экзотермическим процессом, поскольку разрушение структуры растворенного вещества происходит с поглощением определенного количества тепла ( + Н ), а взаи-модействие растворителя с частицами растворенного вещества сопровожда-ется выделением тепла ( - Н). В зависимости от того, какие процессы пре-обладают при растворении, тепловой эффект процесса положительный или отрицательный.
Способность вещества растворяться в данном растворителе характеризу-ется растворимостью. Растворимостью называется число, показывающее, сколько граммов растворенного вещества может раствориться в 100 г раст-ворителя при данной температуре. Растворимость вещества зависит от при-роды вещества, температуры, давления.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Вещества, растворы которых полностью или частично состоят из ионов, называются электролитами. Распад молекул на ионы называется электролитической диссоциацией. При изучении этой темы необходимо обратить внимание на следующее:
1. Диссоциация двух и более основных кислот и двух и более кислотных оснований протекает ступенчато. Например:
Н3РО4  Н+ + Н2РО4-
Н+ + Н2РО4-
Н2РО4 ¯ 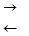 Н+ + НРО42-
Н+ + НРО42-
НРО42 ¯ 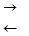 Н+ + РО43-
Н+ + РО43-
Ba(ОH)2 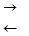 BaOН+ + OH-
BaOН+ + OH-
BaOH+ 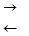 Ba2+ + OH-.
Ba2+ + OH-.
2. В соответствии с величиной степени электролитической диссоци-ации (ά) электролиты делятся на сильные, средней силы и слабые. У силь-ных электролитов ά больше 30 %, у слабых - до 3 %. К сильным электроли-там относятся все растворимые соли, сильные кислоты ( НСl, HNO3, H2SO4 ) ,
а также все растворимые основания ( кроме NH4С1) .
Слабые электролиты диссоциируют частично, процесс диссоциации является обратимым. Например:
СН 3СООН 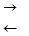 CH 3 COO¯ + Н+,
CH 3 COO¯ + Н+,
К слабым электролитам относятся следующие вещества:
Н2О, NH4OH, H2S, H2CO3, HNO2, CH3COOH.
Дата добавления: 2021-03-18; просмотров: 613;











