Топливо Уд. теплота сгорания
МДж/кг
Дрова 8,3-15,5
Горючий сланец 8,4 – 20
Торф 8,4 – 21
Бурый уголь 10,5 – 21
Каменный уголь ок. 29,4
Антрацит 32,8- 32,6
Природный горючий газ на 1 куб.м 25,2-46,2
Нефть 42
По энергетической ценности виды топлива характеризуются следующим образом:
Топливо Энергетическая ценность
КВт ч /кг
Дрова 2,33-4,32
Горючий сланец 2,33 – 5,82
Торф 2,33 – 4,66
Бурый уголь 2,92 -5,82
Каменный уголь ок. 8,15
Антрацит 9,08 – 9,32
Природный горючий газ на 1 куб.м 6,98 – 12,82
Нефть 11,63
Различные виды топлива соизмеряются по их удельной теплоте сгорания, т.е. по количеству энергии, виделяющейся при сжигании кило-грамма топлива.
Для исчисления общих запасов топлива различные его виды мысленно заменяют так называемым условным топливом с удельной теплотой сгорания 29,4 МДж/кг. Обозначив удельную теплоту сгорания данного топлива через Q, а его количество ( в килограммах или тоннах) через Т, найдем эквивалентное ему количество Х условного топлива по одной из следующих формул:
Х=ТQ /29,4 или Х=ТQ/ 8,15,
в зависимости от того, в каких единицах (МДж/кг или кВт·ч/кг) задана Q.
Практически при соответствующих расчетах принимают:
1т каменного угля = 1 т условного топлива
1т бурого угля = 0,4 т условного топлива
1т нефти = 1,4 условного топлива
1000 м3природного газа = 1,3 т условного топлива
Несколько сложнее соизмерение топливных и нетопливных энергетических ресурсов. Мощность гидроэнергии, измеряемая в киловаттах, зависит от высоты (напора) воды и ее расхода, т.е. количество воды, протекающей в выбранном створе реки в единицу времени. Ее исчисляют следующим образом.
Вода, падая с высоты, производит работу, равную произведению ее веса на высоту падения. Масса воды пропорциональна ее объему. Обозначив через R ее расход, т.е. количество кубометров воды, падающей за секунду, а через Н – высоту падения, выраженную в метрах, можно вычислить мощность N водного потока в киловаттах по следующей формуле:
N=(1000/102) RH=9,8 RH.
В этой формуле 1000 – число килограммов в кубометре воды, а 102 – число килограммометров в секунду, равное одному киловатту мощности.
Принимая средний коэффициент полезного действия гидроустановки равным 0,80-0,85, получаем практическое выражение для потенциальной (теоретической) мощности водного потока:
N= 8RH, кВт.
Понятие условного топлива применяют не только для исчисления общих отходов топлива, но и для исчисления энергетических ресурсов любого вида. Исходной величиной при этом служит среднее количество весовых единиц условного топлива, фактически расходуемых на тепловых электростанциях для получения одного киловатт-часа электроэнергии при данном уровне энергетической техники ( в настоящее время -около 0,35 кг). При помощи этой величины определяют какому количеству условного топлива эквивалентны ресурсы нетопливных источников энергии (количество киловатт-часов электроэнергии, которые можно получить от них за год).
Запасы гидроэнергии на определенной территории представляют сумму потенциальной мощности всех водотоков, умноженную на число часов возможного ее использования за год. Это потенциальные (теоретические) гидроэнергоресурсы. Наряду с ними различают: технически возможные к использованию гидроэнергоресурсы – часть потенциальных, которая при данном уровне техники практически может быть использована; экономически эффективные гидроэнергоресурсы, использование которых при существующих условиях экономически выгодно.
При соизмерении невозобновляющихся и возобновляющихся энергетических ресурсов необходимо учитывать скорость возобновления (прирост древесины, а иногда и торфа).
В состав всех видов топлива входит горючая масса (органическая масса и горючие неорганические вещества: сера, ее соединения и т.д.) и негорючая масса (зола, влага). Чем больше в топливе золы, влаги, тем ниже его теплота сгорания. Чем выше в органической массе содержание углерода и водорода и чем ниже содержание кислорода и азота, тем больше теплота сгорания топлива.
Одним из важнейших видов жидких топлив является нефть, которая содержит в органической части 83-87% углерода и 12-14% водорода. Удельная теплота сгорания нефти колеблется в пределах 35,8-44 МДж/кг.
Природный газ содержит до 98% метана и является наиболее эффективным видом топлива. В пределах Украины имеются практически все виды топлива, в том числе нефть и газ.
2.5. Основные источники и характеристики воды
Вода занимает важное место в жизни и деятельности человека. Распространение воды: 97,57% – в мировом океане, 2,14% – в высокогорных ледниках и полярных льдах, 0,29% – в реках и озерах, в водяных парах атмосферы – около 0,001%. Примерно 7% массы земной коры составляют подземные воды.
Для бытовых и промышленных нужд применяется только пресная вода (содержание солей до 1 г/л), составляющая 3% всех запасов воды.
Расход воды на душу населения в крупных городах США и Европы составляет 600-700л в сутки, в развивающихся странах – 50 л.
В воде содержатся почти все элементы системы Менделеева. Ее обшая масса 1,4х1018т, в ней содержится 2,8 млрд. т урана. Если извлечь из нее только 0,01% содержащегося урана, то его хватит на 100 лет для выработки электроэнергии для всего человечества.
Качество воды определяется ее химическими и физическими характеристиками, такими как жесткость, общее солесодержание, прозрачность, окисляемость и др. Для питьевых нужд большое значение имеет количество токсичных примесей (мышьяк, стронций, радий, радиактивный уран), содержание микробов, запах, цвет и вкус. Для технических нужд важны показатели жесткости, содержание солей, механических примесей.
Жесткость воды характеризуется содержанием в ней солей кальция и магния. Различают жесткость воды трех видов: временную, постоянную и общую.
Временная (устранимая) жесткость характеризуется содержанием в воде бикарбонатов кальция и магния, которые легко удаляются из воды простым кипячением. Бикарбонаты переходят в нерастворимые углекислые соли и выпадают в виде плотного осадка.
Постоянная жесткость воды связана с присутствием в ней хлоридов, сульфатов, нитратов кальция и магния. Эти соли не удаляются при кипячении воды. Временная и постоянная жесткость в сумме дают общую жесткость. Вода имеет жесткость, равную единице, если в литре ее содержится 1 мг-экв ионов кальция или магния. Жесткость вызывает агресивность по отношению к бетону. При содержании 250 млг/л сульфатных ионов наступает разрушение бетонного камня.
Общее солесодержание или сухой остаток – масса вещества, оставшегося после испарения воды и высушивания полученного остатка при 105...110°С до постоянной массы. Сухой остаток выражается в миллиграммах на 1 литр воды.
Прозрачность воды определяется толщиной слоя воды, через который можно различить крест или шрифт определенного размера (без или с помощью фотоэлемента). В открытых районах Черного моря она равна 24...28 м.
Окисляемость воды определяется массой (в миллиграммах) перманганата калия, взаимодействующего с 1 л воды при кипячении в течение 10 минут.
Кислотность или щелочность воды характеризуется концентрацией водородных ионов или величиной pH = – 1g [H+, моль/л].
При pH = 6,5 – 7,5 вода считается нейтральной, при pH < 6,5 воду называют кислотной, при pH > 7,5 – щелочной.
|
| |
|
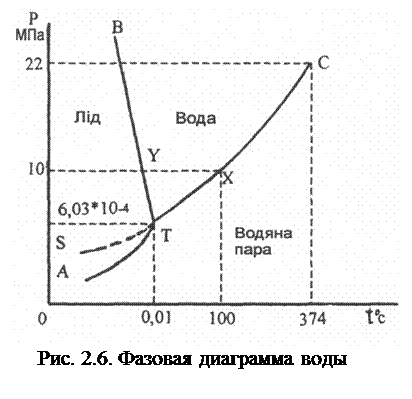 Известно, что вода бывает в трех агрегатных состояниях: газ (пар), вода, лед, которые представляют собой отдельные фазы. Фазы – это гомогенные (однородные) частицы вещества, отделенные одна от другой физическими границами. В системе газа и жидкости фазы находятся в динами-ческом равновесии. Экспе-риментальные данные влия-ния температуры и давле-ния на агрегатное состоя-ние воды может быть изоб-ражено с помощью фазовой диаграммы (рис. 2.6).
Известно, что вода бывает в трех агрегатных состояниях: газ (пар), вода, лед, которые представляют собой отдельные фазы. Фазы – это гомогенные (однородные) частицы вещества, отделенные одна от другой физическими границами. В системе газа и жидкости фазы находятся в динами-ческом равновесии. Экспе-риментальные данные влия-ния температуры и давле-ния на агрегатное состоя-ние воды может быть изоб-ражено с помощью фазовой диаграммы (рис. 2.6).
Например, при определенных значениях темпера-туры и давления, которое соответствует точкам диаг-раммы в плоскости, огра-ниченной кривыми ВТ и СТ, вода существует только в жидком состоянии, в точках ниже кривых АТ и ТС – в виде пара.
Точки на кривых соответствуют условиям, при которых две смежные фазы находятся в равновесии.
Две точки на диаграмме вызывают особый интерес. Точка Т (0,01оС и 6,03·10-4МПа) называется тройной точкой, где в равновесии находятся одновременно три фазы: пар, вода и лед. Точка С (347оС и 22,0 МПа) называется критической. При температуре свыше 374оС пар воды нельзя преобразовать в жидкость при увеличении давления. Иными словами, при температуре и давлении свыше чем в точке С, пар и жидкость воды не различаются. Между ними не существует фазовой линии.
Диаграмма состояния воды играет исключительно важную роль при проектировании и эксплуатации паровых котлов, энергетических турбин энергосистем, автоклавов и т.д.
2.6. КласСификация вод
Природные воды делятся на три вида, различающиеся по наличию примесей: атмосферные, поверхностные и подземные.
Атмосферная вода– это вода дождевых и снеговых осадков, она характеризуется сравнительно небольшим содержанием примесей, главным образом растворенных газов: кислорода, углекислого газа, сероводорода, оксидов азота, кислородных соединений серы, органических веществ, которые определяют атмосферу в промышленных районах. Атмосферная вода почти не содержит растворенных солей, в частности солей кальция и магния.
Поверхностные воды – речные, озерные, морские содержат, кроме примесей, имеющихся в атмосферной воде, разнообразные вещества. В ней есть двууглекислые соли кальция, магния, натрия и калия, а также сернокислые и хлорные соли. При содержании солей менее 1 грамма на литр воды она называется пресной, более одного грамма – соленой.
Подземные воды – артезианских скважин, колодцев, ключей, гейзеров – характеризуются разнообразным содержанием солей, состав которых зависит от вида и структуры почв и горных пород, через которые просачиваются атмосферные воды и воды поверхностных водоемов, образуя подземные водоемы. Фильтрующая способность почв и горных пород обусловливает высокую прозрачность подземных вод и отсутствие в них примесей органического происхождения. Уникальным сырьем для химической промышленности являются минеральные воды, насыщенные различными солями. Так, воды насыщенные хлористым натрием, служат сырьем для производства соды, едкого натра и хлора. Из подземных рассолов получают также йодистые, бромистые соединения и другие соли.
В зависимости от назначения вода условно подразделяется на промышленную и питьевую. Питьевая вода в первую очередь освобождается от бактерий; к ней предъявляются особые требования в отношении вкуса, цвета, запаха. Промышленные воды не должны содержать примесей больше допустимой нормы, которая устанавливается в зависимости от вида производства.
Вода для прямоточных паровых котлов не должна содержать окисей углерода и кислорода, вызывающих коррозийное разрушение труб, и может содержать сухой остаток не более 0,2...0,3 мг/л. Соли в паровых котлах отлагаются на внутренних поверхностях труб в виде накипи, снижают теплопроводность их стенок, приводят к перегреву труб и преждевременному их износу. Повышенные требования в отношении чистоты предъявляются к воде в производстве полупроводников, люминофоров и некоторых других материалов.
2.7 Очистка и обезвреживание воды
Очистка воды от примесей, т.е. подготовка, включает следующие операции: осветление, обесцвечивание, обеззараживание, смягчение, дегазацию.
Осветление и обесцвечивание природной воды производится с целью удаления из нее механических примесей. Это достигается отстаиванием ее в бетонированных резервуарах большой вместимости (отстойниках) с последующим пропусканием через песчаные фильтры с зернистым фильтрующим слоем. Для осаждения коллоидных примесей в отстойники вводят коагулянты – сульфаты железа или алюминия, в результате чего вода обесцвечивается. Осадки удаляются из воды при отстаивании и фильтровании.
Обеззараживание воды – обязательный процесс очистки воды, используемой для бытовых нужд. Уничтожение болезнетворных микробов и окисление органических примесей достигается хлорированием – введением газообразного хлора, хлорной извести, гипохлорида кальция, а также озонированием и кипячением. При обработке воды хлором вода приобретает его запах, при озонировании запах отсутствует, что является достоинством данного метода. Вода обеззараживается также обработкой ионами серебра и при воздействии ультрафиолетовых лучей и ультразвуковых колебаний.
Для того, чтобы после обработки в воде не оставался избыток хлора, ее дехлорируют. При этом избыток хлора либо химически связывается, либо удаляется при пропускании воды через угольные фильтры. Умягчение и обессоливание воды – основные процессы ее подготовки. Удаление из воды всех солей (всех катионов и анионов) называется обессоливанием, только солей кальция и магния – смягчением. Полное обессоливание воды (дистиллирование) применяется сравнительно редко. Способы умягчения воды подразделяются на физические, химические и физико-химические.
К физическим способам относятся – кипячение, дистилляция и вымораживание.
Дистиллированную (полностью обессоленную) воду получают перегонкой на специальных дистилляционных установках.
Сущность химических методов умягчения заключается в связывании ионов кальция и магния при помощи реагентов в нерастворимые и легкоудаляемые осадки. В зависимости от применяемых реагентов различают способы: а) известковый – обработка гашеной известью; б) содовый – воздействуют кальцинированной содой; г) натронный – обработка едким натром; д) фосфатный – воздействуют тринатрийфосфатом.
Сущность ионообменного (физико-химического) способа состоит в удалении из воды ионов кальция и магния при помощи ионитов (ионообменных солей), способных обменивать свои ионы на ионы, содержащиеся в воде.
Современным физико-химическим методом смягчения воды является электрохимический, в частности электрокоагуляция, которая производится в электролизерах с растворимыми электродами.
Дегазация воды– удаление из нее растворенных газов – осуществляется химическим и физическим способами.
Физические способы удаления газов заключаются в аэрации или нагревании воды в вакууме.
Производственные и бытовые сточные воды обычно содержат различные органические и неорганические примеси, которые при сливе в водоемы загрязняют их. Спуск промышленных сточных вод в водоемы производится в соответствии с санитарными правилами, которыми определено предельно допустимое содержание веществ в сточных водах.
Способы очистки и обезвреживания сточных водподразделяются на механические, физико-химические, химические и биологические.
Механические способы очистки сточных вод от примесей заключаются в их отстаивании и фильтровании, в частности, через полупроницаемые мембраны под давлением.
Физико-химические методы основаны на применении флотации, экстракции и адсорбции вредных примесей, отгонки их с водяным паром. Разновидностью физико-химических методов являются термические, например, испарение воды при нагревании и сжигании органической части сухого остатка.
Химические методы очистки сточных вод основаны на использовании окислительно-восстановительных, электрохимических процессов, реакций нейтрализации и перевода вредных веществ в неактивную безвредную форму. Биологический метод заключается в разложении и окислении вредных примесей с помощью микроорганизмов. Среди встречающихся в почве микроорганизмов наиболее многочисленными являются грибы, водоросли и бактерии. Они «атакуют» содержащиеся в сточных водах органические вещества, которые представляют собой прекрасную питательную среду для микробов, и разлагают углеводы, жиры и другие соединения на двуокись углерода, воду и минеральные соли. Различают процессы биологической очистки, протекающие в естественных и искусственно созданных условиях, проводимых на специальных очистных станциях.
2.8. Воздух в технологических процессах
Наряду с природной водой воздух широко используется в различных технологических процессах.
Прежде всего, воздух расходуется в энергетических агрегатах во время сжигания органических энергоносителей (угля, газа, мазута, бензина) – тепловых электростанциях и двигателях внутреннего сгорания. Большие объемы воздуха используют в металлургии: на производство 1т стали его расходуют около 15· 103 м3на 1т меди – примерно 60 · 103м3. Воздух широко используется для транспортирования материалов (пневмотранспорт), при теплопередаче и охлаждении технологических объектов, как рабочее тепло в пневматических системах. Некоторые физические характеристики атмосферного воздуха: плотность – 1,293 кг/м3; средняя молярная масса (условно) – 29; критическая температура – 140,7 0С, критическое давление 3,72 МПа
Существенную роль в промышленности играют отдельные составные воздуха, характеристики которых приведены в табл. 2.1.
Состав воздуха и его свойства
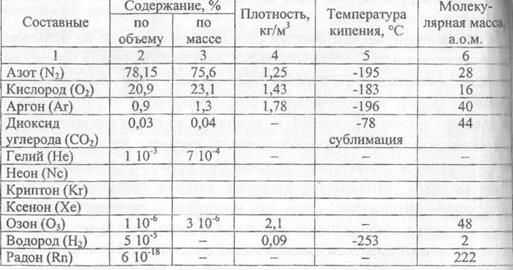
|
Таблица 2.1
Содержание водяного пара в воздухе колеблется от долей процента до нескольких процентов и зависит от местных условий и температуры. Определенной температуре и давлению соответсвует конкретное содержание водяного пара в воздухе. Отношение абсолютной влажности воздуха к максимально возможной, выраженной в %, называется относительной влажностью воздуха.
Зная относительную и абсолютную влажность насыщенной парами воды воздуха, можно вычислить концентрацию воды в воздухе, что иногда является необходимым в технологических процессах. Используя полученные данные и фазовую диаграмму воды (см. рис 2.6), можно предусмотреть условия конденсации водяного пара (выпадание росы) на поверхности машин, изделий, предотвращение возникновения процессов коррозии и др. При охлаждении ниже О0С вода почти полностью конденсируется в лед (иней). При температуре ниже -192 0С и давлении 760 мм водяного столба из воздуха образуется легкоподвижная голубая жидкость плотностью 960кг/м3.
Поскольку температура кипения кислорода (-183 0С) выше температуры кипения азота (-196 0С), кислород легче переходит в жидкое состояние, нежели азот, вследствие чего жидкий воздух богаче на кислород, нежели атмосферный. Жидкий воздух можно достаточно долго хранить в специальных термосах-сосудах Дьюара. Во время хранения жидкий воздух еще больше обогащается на кислород вследствие испарения азота, аргона, и др. методом ректификации - перегонкой.
Горение в чистом кислороде проходит быстрее, нежели в воздухе, и тепло не затрачивается на нагрев азота воздуха. Этот эффект используется для получения высоких температур до 3200 0С) при сжигании (ацетилена, водорода) в специальных горелках, которыми сваривают и разрезают металлы.
Кислород интенсифицирует химические процессы многих производств. В доменном процессе при обогащении кислородом дутья повышается производительность плавки, в производстве серной и азотной кислот, в процессе полимеризации этилена. Смесь сжиженного кислорода с органическим веществом (углем, древесиной) имеет сильные взрывчатые свойства и применяется в горнодобывающей технологии для взрывных работ.
В противоположность кислороду, второй компонент воздуха – молекулярный азот – химически малоактивный газ. Атмосферный азот в больших количествах применяется как исходное вещество для синтеза аммиака и некоторых соединений, а также как инертная среда.
Аргон широко применяется как инертный газ в спецметалургии, сварке, как рабочее тело в плазмотронах. Важное значение в процессах новых технологий имеют и другие инертные газы.
ОСНОВНЫЕ ПОНЯТИЯ
Природное сырье
Искусственное сырье
Минеральное и органическое сырье
Рудное сырье
Полиметаллическое сырье
Обогащение сырья
Концентрат
Хвосты обогащения
Гравитационное обогащение
Магнитная сепарация
Флотация
Качество сырья
Проба благородного метала
Карат
Топливо
Условное топливо
Жесткость воды
Кислотность или щелочность
Фазовая диаграмма воды
Тройная точка
Относительная и абсолютная влажность
Сосуд Дьюара
ВОПРОСЫ ДЛЯ ОБСУЖДЕНИЯ
1. Расскройте понятие “сырье”
2. По каким признакам классифицируется сырье?
Дата добавления: 2016-11-26; просмотров: 2080;











