Металлы и их кристаллическое строение
Металлы – элементы, которые являются хорошими проводниками тепла и электричества, обладают характерным сильным блеском, непрозрачны (в не слишком тонком слое) и образуют с кислородом соединения преимущественно основного типа.
Металлы в твердом состоянии обладают рядом характерных свойств:
· высокой тепло- и электропроводностью;
· положительным температурным коэффициентом электросопротивления (с повышением температуры электросопротивление чистых металлов возрастает; большое число металлов обладает сверхпроводимостью – у этих металлов при температуре, близкой к абсолютному нулю, электросопротивление падает скачкообразно практически до нуля);
· термоэлектронной эмиссией, т. е. способностью испускать электроны при нагреве;
· хорошей отражательной способностью (металлы непрозрачны и обладают металлическим блеском);
· повышенной способностью к пластической деформации.
Эти свойства металлов обусловлены их электронным строением. Металлическое состояние возникает в комплексе атомов, если при их сближении внешние электроны теряют связь с отдельными атомами, становятся общими, т. е. коллективизируются и свободно перемещаются по определенным энергетическим уровням между положительно заряженными и периодически расположенными в пространстве ионами. Устойчивость металла, представляющего собой ионно-электронную систему, определяется электрическим взаимодействием между положительно заряженными ионами и коллективизированными электронами. Такое взаимодействие между ионным скелетом и электронным газом получило название металлической связи.
Сила связи в металлах определяется соотношением между силами отталкивания и силами притяжения между ионами и электронами. Атомы (ионы) располагаются на таком расстояния один от другого, чтобы энергия взаимодействия была минимальной. Этому положению соответствует равновесное расстояние d0 (рис. 1.2).
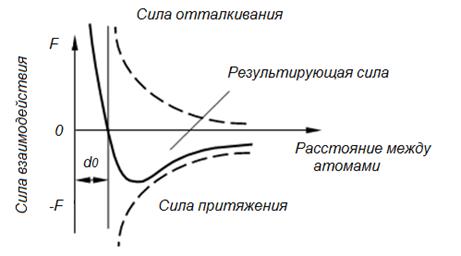
Рис. 1.2. Силы взаимодействия двух атомов
Правильное регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях, образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, называют твердыми телами. Металлы являются телами кристаллическими.
Наиболее простой кристаллической решеткой у металлов является кубическая, имеющая две разновидности: кубическую объемно центрированную (ОЦК) и кубическую гранецентрированную (ГЦК) (рис. 1.3, а–б).
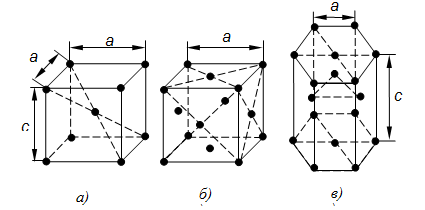
Рис. 1.3. Кристаллические решетки:
а – кубическая объемно центрированная (ОЦК); б – кубическая
гранецентрированная (ГЦК); в – гексагональная плотноупакованная (ГПУ)
У обоих типов этих решеток основу ячеек составляют восемь атомов, образующих куб и находящихся в его вершинах. Остальные атомы находятся или в центре объема куба (1 атом на пересечении диагоналей в решетке ОЦК), или в центре каждой из его граней (6 атомов в решетке ГЦК). Кристаллические решетки ОЦК имеют альфа-железо (Feα), хром, ванадий, вольфрам и другие металлы. Решетку ГЦК имеют гамма-железо (Feγ), алюминий, медь, никель и другие металлы.
Другой разновидностью кристаллических решеток у металлов является гексагональная плотноупакованная решетка (ГПУ). Ячейка этой решетки представляет собой шестигранную призму с центрированными основаниями, между которыми на некотором расстоянии от центров трех граней расположены еще три атома. ГПУ решетку имеют магний, цинк, бериллий и другие металлы (рис. 1.3, в).
Плоскости, параллельные координатным плоскостям и находящиеся на расстоянии а, в, с, разбивают кристалл на множество параллелепипедов, равных и параллельно ориентированных. Наименьший параллелепипед называют элементарной ячейкой. Вершины параллелепипеда называют узлами пространственной решетки. Размер элементарной ячейки оценивают отрезками а, в, с, называемыми периодами решетки.
Период решетки – это расстояние между атомами по ребру элементарной ячейки. Параметры решетки измеряются в нанометрах (1 нм = 10−9 м = 10 Å).
Дополнительными характеристиками кристаллической решетки являются координационное число, коэффициент компактности, базис кристаллической решетки.
Координационное число К – число ближайших равноудаленных частиц (атомов) от любого атома в кристаллической решетке (для ОЦК – К8, для ГЦК – К12). Коэффициент компактности (плотность упаковки) – отношение объема всех частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки (для ОЦК – 0,68, для ГЦК – 0,74).
Базис кристаллической ячейки – число атомов, принадлежащих каждой элементарной ячейке. Для ОЦК, ГЦК и ГПУ базис соответственно равен: Б = 2, 4, 4.
Упорядоченность расположения атомов в кристаллической решетке позволяет четко выделить кристаллографические направления и плоскости (рис. 1.4). Кристаллографические направления – лучи, выходящие из какой-нибудь точки отсчета, вдоль которых на определенном расстоянии друг от друга располагаются атомы.
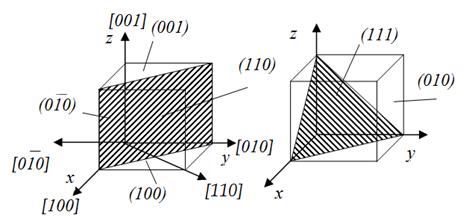
Рис. 1.4. Основные кристаллографические направления и плоскости
Точками отсчета могут служить вершины куба, при этом кристаллографическими направлениями являются его ребра и диагонали грани.
Кристаллографические плоскости – плоскости, на которых лежат атомы, например грани куба или его диагональной плоскости. Кристаллографические направления и плоскости принято обозначать индексами Миллера. Использование понятий о кристаллографических направлениях и плоскостях и об их индексах позволяет описывать различные явления, происходящие в кристаллических телах, а также особенности свойств кристаллических тел вдоль различных направлений и плоскостей.
Физические и прочностные свойства металлов вдоль различных кристаллографических направлений зависят от числа атомов, расположенных на этих направлениях. В действительности в кристаллической решетке на различных направлениях находится разное число атомов. Например, в кубических решетках (рис. 1.4) вдоль диагонали куба ОЦК решетки [111] или диагонали грани решетки ГЦК [110], [101], [011] размещается больше атомов, чем по направлениям вдоль ребер кубов [100], [010], [001].
Из этого следует, что в кристаллических веществах должна наблюдаться анизотропия, т. е. неодинаковость свойств вдоль различных кристаллографических направлений.
Анизотропия – это зависимость свойств кристалла от направления, возникающая в результате упорядоченного расположения атомов в пространстве. Анизотропия механических и других свойств наблюдается при испытании образцов, вырезанных вдоль различных кристаллографических направлений. Не всем свойствам кристаллических тел присуще явление анизотропии, например теплоемкость от направления не зависит.
Анизотропия проявляется только в пределах одного кристаллического зерна. Реальные металлы являются телами поликристаллическими, состоящими из огромного числа зерен, произвольно ориентированных друг к другу своими кристаллографическими направлениями и плоскостями. В связи с этим недостаток какого-либо свойства по одному из направлений приложения силы в одних зернах компенсируется избытком этого свойства по этому же направлению в других зернах. Поэтому реальные металлы являются квазиизотропными телами, т. е. телами с примерно одинаковыми свойствами по всем направлениям.
Дата добавления: 2016-11-04; просмотров: 4181;











