Кристаллическое строение металлов. Типы кристаллических решеток
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место. Причина этого - в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
· «металлический блеск» (хорошая отражательная способность);
· пластичность;
· высокая теплопроводность;
· высокая электропроводность.
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов. Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Все металлы и металлические сплавы – тела кристаллические. Атомы (ионы) расположены в металлах закономерно, в геометрически правильном порядке и образуют пространственную кристаллическую решетку.
Решетка характеризуется наличием каркаса из малоподвижных заряженных ионов, в промежутках которого с огромной скоростью движутся свободные электроны. Если через атомы в кристаллических решетках провести плоскости, то атомы в них будут располагаться в геометрически правильном порядке, образуя кристаллографические плоскости. Наименьший объем металла, который характеризует атомно–кристаллическое строение всего объема, называется элементарной кристаллической решеткой.
Пространственные кристаллические решетки полностью определяют строение кристалла.
Различают простые и сложные кристаллические решетки. В простой решетке атомы (ионы) расположены только в вершинах, а в сложных – они могут находиться также внутри многогранника или на его гранях.
Металлы имеют сложные кристаллические решетки. Всего существует четырнадцать типов решеток, но основными являются три - это:
- Объемно-центрированная кубическая решетка (ОЦК);
- Гранецентрированная кубическая решетка (ГЦК);
- Гексагональная плотноупакованная решетка (ГПУ).
1) В элементарной ячейке ОЦК атомы находятся в вершинах куба и в центре на пересечении пространственных диагоналей. Всего 9 атомов (рис.1).
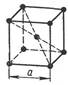
Рисунок 1
2) В гранецентрированной кубической решетке атомы расположены в вершинах куба и в центрах каждой грани куба. Всего 14 атомов (рис.2).
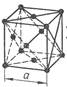
Рисунок 2
3) Гексагональная плотноупакованная решетка. Элементарная ячейка – шестигранная призма, в которой атомы находятся в вершинах и в центре оснований призмы, а также внутри призмы - 3 атома. ГПУ содержит 17 ионов (рис.3).

Рисунок 3
Кристаллические решетки характеризуют следующие основные параметры: период решетки, атомный радиус, координационное число, базис и коэффициент компактности решетки.
- Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки (a,b,с). Периоды решетки выражаются в ангстремах – А (1А=10-8 см).
- Под атомным радиусом понимают половину межатомного расстояния между центрами ближайших атомов в кристаллической решетке элемента при нормальной температуре и атмосферном давлении. Однако атомный радиус не является неизменной величиной, а изменяется в зависимости от ряда факторов, важнейшим из которых являются координационное число и тип химической связи между атомами в кристалле.
- Координационное число Кпоказывает количество атомов, находящихся на наиболее близком и равном расстоянии от любого выбранного атома в решетке. Чет выше координационное число, тем плотнее пространственная кристаллическая решетка материала.
- Базисом решетки называется количество атомов, приходящихся на одну элементарную ячейку решетки.
- Коэффициент компактности η решетки определяется отношением объема, занимаемого атомами Va, ко всему объему решетки Vp, т.е. η = Va / Vp.
Рассмотрим эти параметры для основных типов кристаллических решеток.
ОЦК решетка
Период решетки – а = 0,286 - 0,607 нм.
Координационное число К - 8.
Базис - 2 атома.
Каждый угловой атом входит в восемь соединительных ячеек, следовательно, одной ячейке принадлежит от угловых атомов только 1/8 атома; только внутренний атом целиком принадлежит данной ячейки. Таким образом, на одну ячейку объемно-центрированной кристаллической решетки приходится 8 * 1/8 + 1 = 2 атома.
К.К. η = 68 %.
Объемно-центрированную кубическую решетку имеют металлы: Li, Na, K, V, Cr, Feα, Rb, Nb, Mo, W и др.
ГЦК решетка
Период решетки – а.
Координационное число К – 12.
Базис – 4.
Каждый угловой атом входит в восемь ячеек, а находящийся в центре грани – в две соседние ячейки; в центре атома нет. Следовательно, на одну ячейку приходится 8*1/8+6*1/2 = 4 атома.
К.К. η = 74 %.
Гранецентрированную кубическую решетку имеют металлы: AI, Ca, Feγ, Ni, Cu, Pb, Ag, Pt, Au, Pd и др.
ГПУ решетка
Период решетки а и с (а = 0,228 - 0,398 нм; с = 0,357 - 0,652 нм), причем с/а = 1,633 (если с/а > 1,633, то данная решетка будет гексагональной, но не плотноупакованная, характерная для Mg, Zn).
Базис решетки – 6 атомов.
Координационное число К – 12 (Г12).
На одну ячейку кристаллической решетки приходится 6 атомов: 2 атома, лежащие в центре шестиугольника, входят в две соседние ячейки (2*1/2) = 1атом, а 12 атомов, образующие вершины призмы, - в 6 соседних ячеек (12*16/) = 2 атома, 3 атома, лежащие внутри призмы, целиком принадлежат данной ячейке (3*1 = 3 атома).
К.К. η = 74 %.
В гексагональной системе кристаллизуются Be, Мg, Cd, Ti, Co, Zn и другие металлы.
Многие металлы при разных температурах имеют неодинаковые кристаллические решетки. Это явление называется полиформизмом или аллотропией (например Fe, имеет α и γ решетки).
Дата добавления: 2021-02-19; просмотров: 1147;











