Приращение изобарного потенциала вещества при растворении
Согласно уравнению Гиббса для 1 моля вещества при его растворении приращение изобарного потенциала выразится
ΔGi = ΔHi – TΔSi
где ΔНi = TΔSi – соответственно энтальпия и энтропия растворения.
Для идеальных растворов ΔН = 0 и ΔS = – R ln Ni
Если ввести обозначения ΔНi – TΔS = RTln γiNi
то ΔGi = RT ln ai
В теории металлургических процессов значения ΔG10% вычисляется в расчете на 1 моль растворяемого вещества в предположении, что с растворителем они образуют раствор с концентрацией 1% по массе ( гипотетический раствор ). Принимается, что вещество не меняет агрегатное состояние при переходе в раствор
ΔG10% = RTln γ ξ
где ξ = 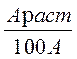
Араст – атомный вес растворителя;
А – атомный вес растворяемого вещества.
Если растворяющее вещество твердое, а растворитель жидкий, то
ΔG10% = ΔHпл ( 1 – 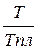 ) + RTln γξ
) + RTln γξ
В литературе имеются сведения о ΔG10% для случая растворения в железе
| Элемент | γ при Т=1500 0С | ΔG10% Дж/моль |
| С Миж Si ж Ti тв Vтв Cr | – 0,0174 0,05 0,12 | 37200 – 50,6 Т – 38,2 Т 122000 – 1,25 Т – 29300 – 46,0 Т – 15500 – 46,3 Т 20966 – 47,35 Т |
Взаимодействие с водородом
Источники водорода – атмосферная влага, влага в покрытии электродов или флюсов, влага ржавчины на свариваемых кромках. Образующиеся водяные пары диссоциируют и повышают Н.
В зависимости от температуры водород может быть молекулярным, атомарным и ионизированным.
При высоких температурах идет диссоциация
Н2 ↔ 2Н – 434,6 кДж/моль и далее ионизация
Н2 ↔ Н + Н+ + – 1748 кДж/моль
х – степень диссоциации.


При температуре столба дуги водород практически полностью диссоциирован.
Практически полное разложение водяного пара с образованием свободного водорода или гидрооксида происходит при взаимодействии с железом и расплавленным шлаком.
Ме + Н2О = МеО + Н2
2FeO + H2O = Fe2O3 + H2
СО + Н2О = СО2 + Н2О
Если водород в атомарном состоянии, то концентрация в металле подчинена линейному закону Н = КРн где К – константа равновесия, зависит от температуры определяется по уравнению
Lg k = – 1745/T – 1,72
Для молекулярного водорода
[ H ] = K 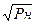
Для смеси атомарного молекулярного водорода
[ H ] = K 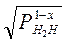
где Рн2н – общее парциальное давление Н2 и Н;
х – степень диссоциации

| |
Водород растворенный в металле, приводит к различным неблагоприятным воздействиям. Выделение избыточного водорода при кристаллизации вследствие резкого падения растворимости приводит к порообразованию. Наличие в ЗТВ или в наплавленном металле растворенного водорода ведет к хрупкости и замедленному разрушению. Он может диффундировать в ЗТВ вследствие малых размеров атомов Н.
Дата добавления: 2016-10-26; просмотров: 1847;











