Разряд аккумулятора
Система электроснабжения автомобиля
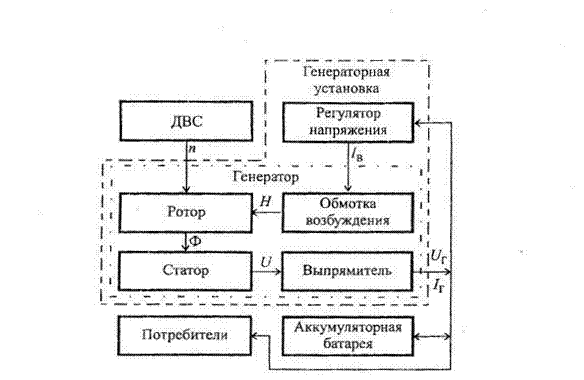
Рис. 1.1. Структурная схема системы электроснабжения автомобиля:
п - частота вращения генератора; 1В - ток в обмотке возбуждения;
U ~ выходное напряжение генератора переменного тока;
Ur - выходное напряжение вентильного генератора;
Н - напряженность; Ф - магнитный поток
Выходное напряжение UT генератора зависит от его нагрузки (силы тока 1Г) и от его частоты вращения п. Поэтому для стабилизации напряжения в бортовой сети автомобиля применяется регулятор напряжения, который соответствующим образом воздействует на ток 1В в обмотке возбуждения генератора.
Аккумуляторные батареи
Аккумуляторные батареи в автомобиле обеспечивают электропитание потребителей при недостаточной мощности энергии, вырабатываемой генератором (например, при неработающем двигателе, при пуске двигателя, при малых оборотах двигателя).
Основными требованиями, предъявляемыми к автомобильным аккумуляторным батареям, являются:
- малое внутреннее сопротивление;
- большая емкость при малых объеме и массе;
- устойчивость к низкой температуре;
- простота обслуживания;
- высокая механическая прочность
- длительный срок службы;
- незначительный саморазряд;
- невысокая стоимость.
Наиболее полно этим требованиям удовлетворяют свинцово-кислотные аккумуляторные батареи.
Электрохимические процессы в свинцовых аккумуляторах.
Аккумулятор накапливает и хранит в себе химическую энергию активных материалов и преобразует её в электрическую.
Активными веществами заряженной аккумуляторной батареи являются двуокись свинца РbO2 (положительный электрод), губчатый свинец Рb (отрицательный электрод) и электролит — водный раствор серной кислоты (H2SO4 + Н2O).
Разряд аккумулятора
На отрицательном электроде:
Pb + SO 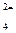 > PbSO4 +2e
> PbSO4 +2e
На положительном электроде:
РbО2 + 4Н+ + SO 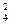 + 2е > PbSO4 + 2Н2О
+ 2е > PbSO4 + 2Н2О
Суммарная реакция:
РbО2 + Рb + 2H2SO4 > 2PbSO4 + 2Н2О
Заряд аккумулятора
На отрицательном электроде:
PbSO4 + 2е > Рb + SO 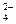
На положительном электроде:
PbSO4 + 2Н2О - 2е > РbО2 + 4Н+ + SO 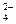
Суммарная реакция:
2PbSO4 + 2Н2О > РbО2 + Рb + 2H2SO4
В конце заряда аккумулятора плотность электролита перестает изменяться, т.к. процессы преобразования веществ на электродах заканчиваются. При продолжении заряда происходит интенсивное разложение воды на кислород и водород, что создает эффект кипения электролита. Неизменность плотности электролита или его кипение служат признаком окончания зарядного процесса.
Дата добавления: 2016-10-18; просмотров: 1596;











