Метод молекулярных орбиталей
Согласно методу МО электроны в молекулах распределены по МО, которые подобно АО характеризуются определенной энергией и формой. В отличие от АО, молекулярные орбитали охватывают систему атомов, т.е. являются многоцентровыми.
Наиболее широко в методе МО используется линейная комбинация АО (ЛКАО). При образовании МО из соответствующих АО должны соблюдаться следующие правила:
1. Число МО равно общему числу АО, из которых комбинируется МО.
2. Энергия одних МО оказывается выше, других – ниже энергии исходных АО. Средняя энергия МО, полученных из набора АО, приблизительно совпадает со средней энергией этих АО.
3. Электроны заполняют МО, как и АО, в порядке возрастания энергии, при этом соблюдается принцип Паули и правило Гунда .
4. Наиболее эффективно комбинируются между собой те АО, которые характеризуются соответствующими энергиями и соответствующей симметрией.
5. Как и методе ВС, прочность связи в методе МО пропорциональна степени перекрывания орбиталей.
Если обозначить АО атомов А и В через 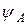 и
и 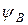 , а МО через
, а МО через 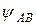 , то согласно ЛКАО
, то согласно ЛКАО
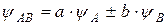 ,
,
где: 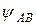 – волновая функция электрона в молекуле (МО); a и b – коэффициенты, учитывающие долю каждой АО в образовании МО;
– волновая функция электрона в молекуле (МО); a и b – коэффициенты, учитывающие долю каждой АО в образовании МО;
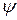 и
и 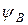 – волновые функции электронов (АО) атомов А и В соответственно.
– волновые функции электронов (АО) атомов А и В соответственно.
При знаке плюс получаются связывающие МО, при знаке минус – разрыхляющие МО (обозначаемые знаком *). Образование МО молекулы водорода из s-AO атомов водорода можно представить следующей энергетической диаграммой.
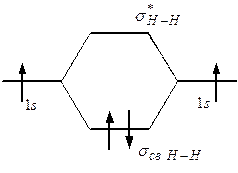
Можно видеть, что согласно вышеприведенным правилам заполнения МО, образующаяся молекула Н2 обладает минимумом энергии, что обусловливает ее стабильность.
Дата добавления: 2016-10-07; просмотров: 1687;











